МЫШЬЯКА КИСЛOТЫ ОРГАНИЧЕСКИЕ
. Различают производные As(V) и As(III); координац.
числа соотв. 4 и 3. К первым относятся о р г а н о а р с о н о в ы е и о р г
а н о а р с и н о
в ы е к-т ы общих ф-л соотв. RAs(X)(XH)2 и R2As(X)XH,
где R-opг. радикал
(обязательно связь As—С), X = О, S. Кислородсодержащие к-ты Аs(V)-кристаллич.
в-ва, многие из них плавятся без разложения, напр. для CH3As(O)(OH)2
т.пл. 161 °С, для C6H5As(0)(OH)2 163°С,
для (CH3)2As(O)OH 195 °С; хорошо раств. в воде, этаноле,
плохо-во мн. неполярных орг. р-рителях; рК1 двух- и рК одноосновных к-т обычно 3-4, рК2 8-9. Тиокислоты менее
устойчивы (напр., органотритиоарсоновые к-ты разлагаются при обычных условиях,
выделены лишь их соли) и потому мало изучены.
При нагр. арсоновые и арсиновые
к-ты отщепляют Н2О (или H2S) и образуют ангидриды; при
длит. нагревании происходит разрыв связи As—С. В р-циях с основаниями образуют
соли, с ионами металлов (U, Тh, РЗЭ) - окрашенные комплексы (эту р-цию используют
в аналит. химии). При нагр. с минер. к-тами или при действии галогенов связь
As—С обычно расщепляется. Кислородсодержащие к-ты As(V) этерифицируют спирты
и гликоли, при действии РСl5 или SOCl2 образуют хлорангидриды,
при обработке три-органогалогенсиланами - эфиры RnAs(O) (OSiR3)3-n
(п = = 1,2).
К-ты с ароматич. заместителями
в присут. минер. к-т могут циклизоваться, напр.:
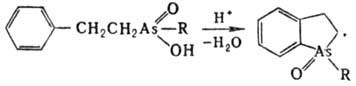
Арсоновые и арсиновые к-ты
легко восстанавливаются до производных As(III), напр.:
Мн. к-ты As(V) и их соли
ядовиты для теплокровных, напр. для Na-соли 4-(ацетамино)фениларсоновой к-ты
ЛД50 550 мг/кг (крысы, внутривенно), они обладают также сильным противомикробным
действием.
Орг. к-ты As(V) получают:
действием алкилгалогенидов на соли к-т As(III) [т. наз. р-ция Мейера (1)]; взаимод.
арил-диазосоед. с солями к-т As(III) {Барта реакция (2)]; нагреванием
аренов с мышьяковой к-той H3AsO4 [р-ция Бешана (3)]; окислением
производных As(III), используя в качестве окислителей Н2О2,
HgO2, хлорамин Т и др. (4):
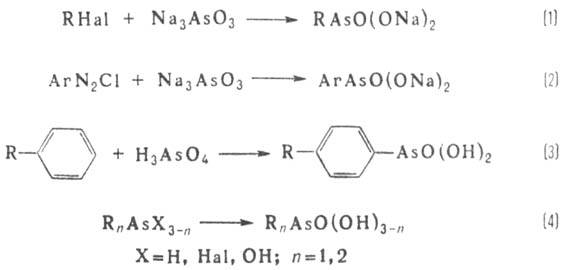
Последнюю р-цию часто используют
в лаб. практике.
К М.к.о., содержащим As(III),
относятся органоарсо-нистые и органоарсинистые к-ты общих ф-л соотв. RAs(XH)2
и R2As(XH), где R-opr. радикал, X = O,S. Эти к-ты менее устойчивы
и менее изучены, чем арсоновые и арсиновые к-ты. Алкиларсонистые и органодитиоарсони-стые
к-ты в своб. состоянии не выделены, известны только их соли, эфиры и ангидриды.
Кислородсодержащие к-ты As(III) обычно кристаллич. в-ва [напр., для м-NO2C,H4As(OH)2
т.пл. 147-151 °С, для (o-CH3C6H4)2AsOH
140-141 С]; нек-рые тиоарсинистые к-ты - перегоняющиеся в вакууме жидкости [напр.,
для C6H4(C2H5)AsSH т.кип. 86-90
°С/10 мм рт.ст.]. М.к.о. As(III) раств. в воде, этаноле и др. орг. р-рителях;
кислые св-ва слабее, чем у к-т As(V). При нагр., как правило, отщепляют Н2О
(или H2S) и образуют олигомерные ангидриды (устойчивость к нагреванию
возрастает с увеличением электроноакцепторной способности R). При сильном нагревании
R2AsOH образуются арсины R3As и As2O3.
Считают, что в воде неустойчивые алкил-арсонистые к-ты находятся в равновесии
с их ангидридами:
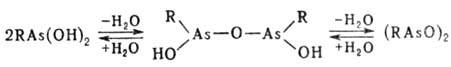
М.к.о. As(III) и их ангидриды
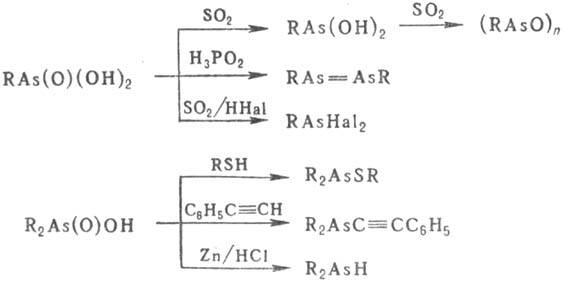
этерифицируют спирты, при действии галогенидов фосфора образуют галогенангидри-ды,
с ангидридами карбоновых к-т-смешанные ангидриды, при действии восстановителей
- арсины и диарсины.
Получают к-ты As(III) и
их ангидриды восстановлением соответствующих к-т As(V), а также действием Н2О
или H2S на галогенарсины. Диорганотиоарсинистые к-ты удобно получать
действием RCOOH па тиооксиды третичных арсинов, напр.:

М.к.о. используют как реагенты
в аналит. химии (напр., арсеназо
, торон
)и лек. ср-ва (напр., осарсол
- 3-ацетами-но-4-гидроксифениларсоновая к-та).
К-ты As(III) и их производные-сильные
яды.
Лит. см. при ст.
Мышьякорганические соединения
. Г. И. Дрозд.
|

