АЗОТ
(от греч. а--приставка, здесь означающая отсутствие, и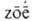 -жизнь;
лат. Nitrogenium, от nitrum - селитра и греч. gennao - рождаю, произвожу)
N, хим. элемент V гр. периодич. системы, ат. н. 7, ат. м. 14,0067. Прир.
А. состоит из двух стабильных изотопов- 14N (99,635%) и 15N
(0,365%). Конфигурация внеш. электронной оболочки 2s22p3;
степень окисления от + 5 до — 3; энергия ионизации при последоват. переходе
от № к N7+ соотв. 14,533, 29,600, 47,454, 77,470, 97,886, 552,070,
667,010 эВ; электроотрицательность по Полингу 3,05; радиусы: ковалентный
0,074 нм, Ван-дер-Ваальса 0,15нм, ионные (в скобках указаны координац.
числа) для N3- 0,132 нм (4), для N3 +
0,030 нм (6), для N5+ 0,004 нм (3) и 0,027 нм (6).
-жизнь;
лат. Nitrogenium, от nitrum - селитра и греч. gennao - рождаю, произвожу)
N, хим. элемент V гр. периодич. системы, ат. н. 7, ат. м. 14,0067. Прир.
А. состоит из двух стабильных изотопов- 14N (99,635%) и 15N
(0,365%). Конфигурация внеш. электронной оболочки 2s22p3;
степень окисления от + 5 до — 3; энергия ионизации при последоват. переходе
от № к N7+ соотв. 14,533, 29,600, 47,454, 77,470, 97,886, 552,070,
667,010 эВ; электроотрицательность по Полингу 3,05; радиусы: ковалентный
0,074 нм, Ван-дер-Ваальса 0,15нм, ионные (в скобках указаны координац.
числа) для N3- 0,132 нм (4), для N3 +
0,030 нм (6), для N5+ 0,004 нм (3) и 0,027 нм (6).
Молекула А. двухатомна, связь между атомами тройная (длина 0,110 нм).
Энергия термич. диссоциации молекулы велика (941,64 кДж/моль), поэтому
диссоциация становится заметной лишь при очень высоких т-рах. Так, при
3000°С и нормальном давлении диссоциирована лишь 0,1% молекул.
Общее содержание А. в земной коре 1*10-2 % по массе. Наиб.
часть А. находится в своб. состоянии в атмосфере (А-главная составная часть
воздуха: 75,6% по массе или 78,09% по объему). В связанном состоянии А.
встречается в воздухе, в водах рек, морей и океанов. В земной коре он образует
три осн. типа минералов, содержащих ионы CN-, NO3-
и NH+4. Пром. значение имеет натриевая (чилийская)
селитра NaNO3, крупные залежи к-рой находятся в Чили; в сравнительно
больших кол-вах встречается калиевая (индийская) селитра KNO3.
В виде нейтральных и ионизир. атомов, а также в виде соед. [NO, (CN)2,
NH3] А. обнаружен в составе газовых облаков комет, в туманностях
и в атмосфере Солнца.
А. входит в состав всех живых организмов. В небольших кол-вах содержится
в каменном угле (1,0-2,5%) и нефти (0,2-1,7%). Велико значение А. в жизнедеятельности
растений и животных: в белках его до 17%, в организме человека в целом
ок. 3%.
А. участвует в круговороте в-в в природе. Значит. его кол-во поступает
в почву в результате жизнедеятельности азотфиксирующих бактерий, способных
переводить своб. А. в соединения (см. Азотфиксация
), а также в результате
нек-рых др. природных процессов. Проблема связывания атм. А. была решена
в нач. 20 в. с освоением пром. синтеза NH3 из N2
воздуха и Н2.
А.-бесцв. газ; т. кип. - 195,80°С, т. пл. -210,00°С; плотн. 1,25046
кг/м3 (0°С), жидкого-0,808 г/см3 (-195,80°С); тройная
точка: т-ра -210,00°С, давл. 125,03 гПа; tкрит-146,95°С, ркрит
3,9 МПа, dкрит 0,304 г/см3; уравнение температурной
зависимости давления пара: lgp(MM рт.ст.) = 7,65894-359,093/7 (52-483 К);
для газа С0p 29,125 ДжДмоль*К), S°298191,498
Дж/(моль*К); теплопроводность 0,077 (82 К), 0,243 (273 К), 0,315 (373 К),
0,725 ВтДм * К) (1273 К);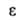 1,000 (298 К), 1,445 (75 К). Для жидкого А. в контакте с воздухом
1,000 (298 К), 1,445 (75 К). Для жидкого А. в контакте с воздухом 8,5
Н/см (-196,15 °С).
8,5
Н/см (-196,15 °С).
В твердом состоянии при обычном давлении А. существует в двух модификациях:
ниже — 237,54°С устойчива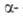 форма с кубич. решеткой типа СО (а = 0,5667 нм, пространств. группа
Р213; плотн. 1,0265 г/см3 при - 252,50°С), выше —
237,54 °С-
форма с кубич. решеткой типа СО (а = 0,5667 нм, пространств. группа
Р213; плотн. 1,0265 г/см3 при - 252,50°С), выше —
237,54 °С-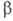 -форма
с гексаген, решеткой типа MgO (а = 0,393нм, с = 0,650нм, пространств, группа
Р63/ттс;
плотн.
0,8792 г/см3 при -210,00°С);
-форма
с гексаген, решеткой типа MgO (а = 0,393нм, с = 0,650нм, пространств, группа
Р63/ттс;
плотн.
0,8792 г/см3 при -210,00°С); Н° перехода
0,231 кДж/моль. Выше 350 МПа существует третья модификация с тетрагон.
кристаллич. решеткой.
Н° перехода
0,231 кДж/моль. Выше 350 МПа существует третья модификация с тетрагон.
кристаллич. решеткой.
Р-римость А. в воде (см3 в 100 мл): 2,33 (0°С), 1,42 (40°С),
1,32 (60°С). В нек-рых углеводородах (гексане, гептане и др.) А. растворяется
лучше, чем в воде. Растворимость в этаноле и метаноле при 0°С примерно
такая же, как в воде.
Большая энергия диссоциации молекулярного А.-причин а исключительно
малой
его реакц. способности. Лишь с нек-рыми активными металлами (напр., с Li,
Cs) А. реагирует при невысоких т-рах. С большинством др. простых в-в А.
если и реагирует, то лишь при высокой т-ре, а иногда только при участии
катализаторов.
Молекулярный А. может быть активирован соед. переходных металлов и затем
превращен при обычных т-ре и давлении в NH3, гидразин или ароматич.
амины. Наиб. активны в этих р-циях соед. Ti, V, Cr, Mo, Fe; восстановителями
служат литий-, магний- или алюминийорг. соед., гидриды металлов, щелочные
металлы, их аддукты с ароматич. углеводородами и др. Процесс проводят в
апротонных средах (эфирах или углеводородах), при этом нек-рые системы
[напр., (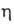 5-C5H5)2TiCl2-RMgHal]
так активны, что поглощают А. с высокими скоростями даже при т-рах от —
100 до — 80 °С. При использовании в кач-ве катализаторов гидроксидов Ti(III)
и Сг(П), амальгамы Na и соед. Мо А. удается восстановить в протонных средах
(водно-мета-нольные р-ры щелочи).
5-C5H5)2TiCl2-RMgHal]
так активны, что поглощают А. с высокими скоростями даже при т-рах от —
100 до — 80 °С. При использовании в кач-ве катализаторов гидроксидов Ti(III)
и Сг(П), амальгамы Na и соед. Мо А. удается восстановить в протонных средах
(водно-мета-нольные р-ры щелочи).
Ключевая стадия всех этих р-ций - связывание А. в комплекс с соед. переходного
металла, при к-ром активируется молекула N2. Известны комплексы,
в к-рых с одним атомом металла координированы одна, две или три молекулы
N2, напр. [СоН(N2){(С6Н5)3Р}3]
цис-
[Mo(N2)2{(CH3)2C6H5P}4],
[Mo(N2)3{(C3H7)2C6H5P}3],
а также биядерные комплексы, напр.
[{( -C5H5)2Ti(C6H5)2}2N2],
[{Ru(NH3)5}2N2][BF4]4,
-C5H5)2Ti(C6H5)2}2N2],
[{Ru(NH3)5}2N2][BF4]4,
в к-рых азотный лиганд служит мостиком между двумя атомами металла.
В большинстве этих комплексов группы М—N=N и М—N=N—M линейны.
С кислородом А. заметно взаимод. только выше 2000 °С с образованием
NO, к-рый легко окисляется далее до NO2 (см. Азота оксиды
).
При
действии ионизирующих излучений на смеси N2 с О2
образуются оксиды А., а в присут. воды-НNО3. О кислородных соед.
А. см., напр., Азотистая кислота
, Азотная кислота
, Азотноватистая кислота
,
Нитраты неорганические
.
С водородом А. реагирует лишь при высоких т-ре и давлении в присут.
катализатора с образованием аммиака
. Косвенными путями получены
гидразин N2H4 и азотисто-водородная к-та HN3,
образующая соли-азиды. Ниже -15°С существует тетразен H2NN=NNH2.
С галогенами А. непосредственно не реагирует. Однако косвенными путями
можно получить соед. со связями N—Hal: галогенамины NHal3, NHHal2,
NH2Hal и др., трифтораминоксид NOF3, нитрозилгалогениды
NOHal, ни-трилгалогениды NO2Hal, галогеназиды N3Hal
и др. Наиб. устойчивы NF3, NOF и NO2F (см. Азота фториды
). Трихлорид азота (трихлорамин) NC13-ярко-желтая
маслянистая жидкость; т. пл. -27°С, т. кип. 71 °С; d4201,653;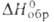 229 кДж/моль; взрывчат; раств. в бензоле, CS2, СС14,
СНС13; получают взаимод. С12 с р-рами NH3
или NH4C1. Нитрози л хлорид NOC1-красно-оранжевый газ:т. пл.
-59,6°С,т. кип. -6°С;плотн. 1,592 г/см3(-6°С);
229 кДж/моль; взрывчат; раств. в бензоле, CS2, СС14,
СНС13; получают взаимод. С12 с р-рами NH3
или NH4C1. Нитрози л хлорид NOC1-красно-оранжевый газ:т. пл.
-59,6°С,т. кип. -6°С;плотн. 1,592 г/см3(-6°С);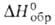 52,5 кДж/моль; заметно диссоциирует на NO и С12 уже при ~20°С;
с H2SO4 образует нитрозилсерную к-ту (NO)HSO4;
является одним из компонентов царской водки. Получают его взаимод. HNO3
или NO2 с NaCl при нагр., а также р-цией NO с С12
при 40-50 °С в присут. А12О3. Используют как окислитель,
хлорирующий и нитрующий агент, катализатор в орг. синтезе. Фторазид N3F-зеленовато-желтый
газ, т. пл. — 154°С, т. кип. -82°С; хлоразид N3Cl-бесцв. газ,
т. пл. - 100°С, т. кип. — 15°С; бромазид N3Вr-красная жидкость,
т. пл. -45°С; иодазид N3I-желтые кристаллы.
52,5 кДж/моль; заметно диссоциирует на NO и С12 уже при ~20°С;
с H2SO4 образует нитрозилсерную к-ту (NO)HSO4;
является одним из компонентов царской водки. Получают его взаимод. HNO3
или NO2 с NaCl при нагр., а также р-цией NO с С12
при 40-50 °С в присут. А12О3. Используют как окислитель,
хлорирующий и нитрующий агент, катализатор в орг. синтезе. Фторазид N3F-зеленовато-желтый
газ, т. пл. — 154°С, т. кип. -82°С; хлоразид N3Cl-бесцв. газ,
т. пл. - 100°С, т. кип. — 15°С; бромазид N3Вr-красная жидкость,
т. пл. -45°С; иодазид N3I-желтые кристаллы.
С серой А. непосредственно не реагирует. Косвенными методами получены
нитриды серы: N4S4- оранжево-желтые кристаллы, которые
выше температуры плавления (179°С) или при ударе разлагаются со взрывом;
весьма неустойчивый N5S5-красная жидкость; (SN)X,
S2N2, S4N2, S5N6
и др.
При действии А. на раскаленный угольный кокс образуется дициан (CN)2.
С металлами А. дает нитриды
. При высокой т-ре А. взаимод. с Si,
а также с Са, Sr, Ba, Ti, W, V, Сг, Mn, Zr, Та, Mo, U, РЗЭ. Азот с СаС2
образует при высокой т-ре CaCN,. Нагревая смесь соды с углем на воздухе,
получают NaCN. При 1500°С А. взаимод. с ацетиленом, давая HCN.
А. входит в состав многочисл. орг. соед.-аминов, аминокислот, нитратов
и др.
При действии электрич. разряда на молекулярный А. при давл. 130-260
Па может образоваться активный А.-смесь возбужденных молекул и атомов А.
Он образуется также при взрыве смеси О2 и СО в присут. А., электрич.
разряде в воздухе. Активный А. энергично взаимод. при комнатной температуре
с атомарными кислородом и водородом, парами серы, белым фосфором и некоторыми
металлами.
А. в лаборатории м. б. получен по р-циям: NH4NO2
-> N2 + 2Н2О (практически пользуются смесью р-ров
NH4C1 и NaNO2); (NH4).Cr2O7
->N2 + Cr2O3 + 4Н2О. Наиб.
чистый А. получают термич. разложением NaN3. В пром-сти А. извлекают
из воздуха (см. Воздуха разделение
).
В неорг. соединениях А. в форме NH4 обнаруживают по желтому
окрашиванию с Несслера реактивом
и др. методами; в форме NO3
-
пo синему окрашиванию с дифениламином, красному окрашиванию с бруцином
и др.; в форме NO-2 -по красному окрашиванию реактива
Грисса (р-р сульфаниловой к-ты и а-нафтиламина в разб. уксусной к-те).
Количественно А. определяют ионизационными методами, методом изотопного
разбавления (см. Газовый анализ
). А. также определяют, связывая
его Li, Mg, Са или др. металлом либо окисляя кислородом в искровом разряде
или в электрич. дуге с послед. поглощением образовавшегося NO2
р-ром щелочи. В форме NO-3 А. определяют гравиметрически
с использованием в кач-ве осадителя нитрона, фотометрически с применением
2,4-фенолдисульфокислоты в конц. H2SO4 либо восстановлением
цинком до NH3 с послед, его отгонкой в определенный объем р-ра
к-ты. В форме NO2 А. определяют перманганатометрически или гравиметрически
по кол-ву AgBr, а также фотометрически с реактивом Грисса; в форме нитридов-по
кол-ву NH3, образовавшегося после растворения образца; в форме
оксидов-по изменению объема газовой смеси после восстановления либо титриметрически
после растворения в соответствующем жидком поглотителе.
Об определении А. в орг. соединениях см. Ван С лайка метод, Дюма метод
, Къелъдаля метод, Прегля методы
, Шёнигера
[Шенигера] методы.
Осн. область использования А.-синтез NH3. Своб. А. применяют
как инертную среду при нек-рых хим. и металлургич. процессах, в овощехранилищах,
при перекачивании горючих жидкостей. Жидкий А.-хладагент (в криостатах,
вакуумных установках и др.).
Газообразный А. хранят в баллонах черного цвета с желтой надписью "азот",
подчеркнутой коричневой полосой, жидкий А.-в сосудах Дьюара, также черного
цвета.
Мировое произ-во А. ок. 72 млн. т/год (1978).
А. открыт Д. Резерфордом в 1772.
Лит.: Шилов А. Е., "Успехи химии", 1974, т. 43, а 5, с. 863-902;
Жаворонков Н. М., "Ж. Всес. хим. об-ва им. Д.И. Менделеева", 1978, т. 23,
в. 1, с. 9-22; Проблемы фиксации азота. Неорганическая и физическая химия.
Биохимия, пер. с англ., М., 1982; Новое в химической фиксации азота, пер.
с англ., М., 1983; Jones К, The chemistry of nitrogen, Oxf., 1975 (Pergamon
texts in inorganic chemistry, v. II). Н. М. Жаворонков.

