НАФТИРИДИНЫ
(пиридопиридины),
мол. м. 130,15. Известно шесть возможных изомеров: 1,5-Н. (ф-ла I), т. пл. 75°С;
1,6-Н. (II), т. пл. 35-36°С; 1,7-Н. (III), т. пл. 64°С; 1,8-Н. (IV),
т. пл. 98-99°С; 2,6-Н. (V), т. пл. 118-119°С, 2,7-Н. (VI), т. пл. 92-94
°С. Молекулы Н. плоские.

Н.-более слабые основания,
чем хинолин и изохинолин; для 1,5-Н. рКа 2,91, для 1,6-Н.
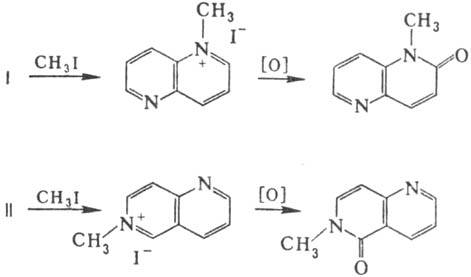
рКа 3,78. Алкилирование Н. идет по одному или обоим атомам
N, причем в случае 1,6- и 1,7-Н. атака прежде всего направляется на т. наз.
изохиноли-новые атомы N с образованием продуктов моноалкилиро-вания-ионов 6-
и 7-алкилнафтиридиния соотв. Продукты моноалкилирования Н. легко окисляются
под действием K3Fe(CN)6 в щелочной среде до N-алкил-a-нафтиридино-нов,
напр.:
Восстановление Н. действием
Na в спирте приводит к транс
-декагидронафтиридинам, каталитич. гидрирование
в присут. РtO2 или Pd-к тетрагидронафтиридинам (идет восстановление
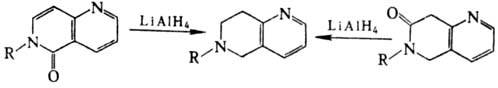
одного из пиридиновых циклов). Действие LiAlH4 на N-алкил-a-нафтиридиноны
дает тетрагидронаф-тиридины:
Н.-электронодефицитные
гетероароматич. системы. Они с трудом вступают в р-ции электроф. замещения.
Так, для незамещенных Н. известно лишь бромирование, к-рое осуществляется при
нагр. с Вr2 в олеуме или действии Вr2 в ССl4
в присут. пиридина и идет в р-положение к гетеро-атому. При избытке Вr2
м.б. получены дизамещенные Н.; напр., из 1,7-Н.-3,5-дибром-1,7-нафтиридин. Бромирование
Н. при высокой т-ре в газовой фазе, идущее по радикальному механизму, направляется
в a-положение к гетероато-му; напр., бромирование 1,5-Н. при 500 °С приводит
гл. обр. к 2,6-дибром-1,5-нафтиридину. Нитрование идет лишь для Н., содержащих
электронодонорные заместители, напр. для нафтиридинонов. Н. легко реагируют
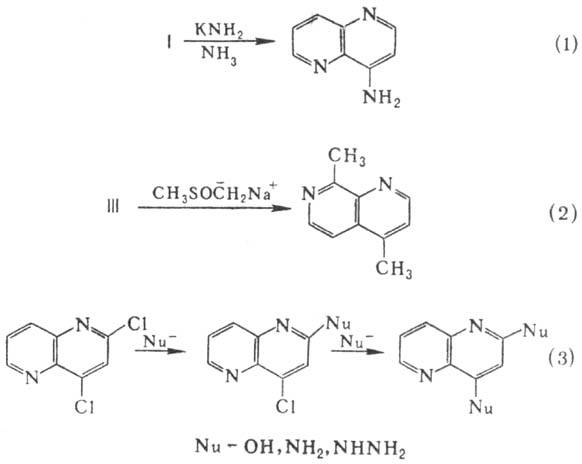
с нуклеофилами, напр. подвергаются аминированию по Чичибабина реакции
(ур-ние
1), метилированию метилсульфинилметильным анионом, получаемым действием сильных
оснований на ДМСО (2), по a- и g-положениям к атомам N. Галогенза-мещенные Н.
обменивают атом галогена на разл. нук-леофилы (3).
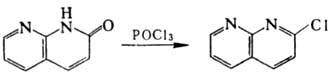
Гидроксинафтиридины, существующие
в таутомерией форме нафтиридинонов, при действии РОСl3 превращ. в
хлорпроизводные, напр.:
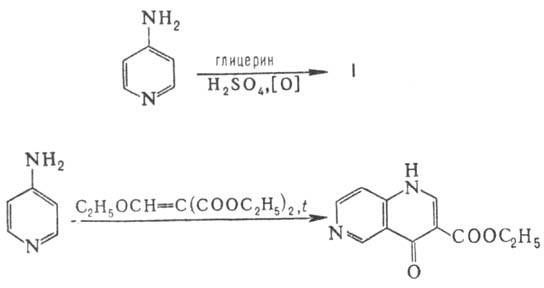
Н. обычно получают методами,
аналогичными методам синтеза хинолинов. Незамещенные Н. могут быть получены
из аминопиридинов по Скраупа реакции
, замещенные - конденсацией аминопиридинов
с этоксиметиленмалоновым эфиром, напр.:
Н.-структурные фрагменты
нек-рых алкалоидов. Ряд производных Н. обладает физиол. активностью; в частности,
известны модифицир. пенициллины (апальцилин) и цефалоспорины, содержащие остатки
1,5-Н.; 7-метил-1-этил-4-оксо-1,8-нафтиридин-3-карбоновая к-та (налидиксовая
к-та, или невиграмон) - антибактериальный препарат.
Лит.: Чуба В., "Химия
гетероциклических соединений", 1979, №1, с. 3-16; Норовян А. С., Пароникян
Е. Г., Вартанян С. А., "Хим.-фарма-цевтич. ж.", 1985, № 7, с. 790-800;
Paudler W. W., Kress T.J., в сб.: Advances in Heterocyclic Chemistry, v. 11,
N.Y., 1970, p. 127-75; Van der Plas H.C, WozniakM., Van den Haak H.J., там же,
v. 33, N.Y., 1983, p. 95-146; Paudler W. W., Sheets R.M., там же, v. 33, N.Y.,
1983, p. 147-84.
Л. И. Беленький.
|

