НИТРАТЫ ОРГАНИЧЕСКИЕ
,
эфиры азотной к-ты HNO3. Содержат одну или неск. групп -О-NO2,
связанных с орг. радикалом ковалентной связью.
Н. о.-бесцв. или бледно-желтые
жидкости либо твердые в-ва (см. табл.), плохо раств. в воде, с водой и этанолом
часто образуют азеотропные смеси, хорошо раств. в орг. р-рителях.
СВОЙСТВА НЕКОТОРЫХ ОРГАНИЧЕСКИХ
НИТРАТОВ

* При 22°С. ** При
12 °С.
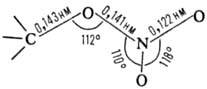
Группа С—ONO2-плоская
(длины связей и углы показаны на структурной ф-ле), с низким барьером вращения
вокруг связей С—О и О—NO2. В ИК спектрах присутствуют две характеристич.
полосы, соответствующие симметричным и антисимметричным валентным колебаниям
группы NO2 при 1272-1282 и 1626-1634 см-1 соответственно.
В спектрах ЯMP14N и 15N хим. сдвиг атома азота d от 0
до — 50 м.д., в спектре ПМР группа ONO2 сдвигает сигнал a-Н-атома
в слабые поля на 0,5-0,7 м. д. по сравнению с соответствующими спиртами. Для
низших алкилнитратов m 9,7.10-30Кл.м.
Н. о. чувствительны к удару
и при хранении возможно их самопроизвольное разложение со взрывом; кислые примеси
увеличивают склонность к разложению. Алкилнитраты при нагр. выше 150°С в
контролируемых условиях превращ. в алкилнитриты. С нуклеофилами (В-)
алкилнитраты реагируют по неск. направлениям: нуклеоф. атака на атом N (путь
а) или на атом С (б), отрыв атома водорода от a-углеродного атома
с образованием карбонильного сосд. (в) или от b-углеродного атома с образованием
алкена (г):
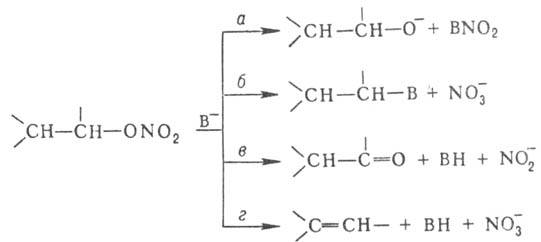
Первичные алкилнитраты
претерпевают гл. обр. сольволиз; бензилнитрат и особенно его производные, содержащие
в бензольном кольце электроноакцепторные заместители, а также вторичные нитраты
(даже в отсутствие активирующих заместителей) образуют соответствующие карбонильные
соед.; третичные нитраты дают алкены. Нек-рые алкилнитраты быстро реагируют
по атому N, благодаря чему в присут. оснований м. б. использованы в качестве
эффективных нитрующих агентов [напр., нитрат ацетонциангидрина (CH3)2C(CN)ONO2
или изоамилнитрат] для соед. с активной метиленовой группой, гетероциклов и
т.п. Такие нуклео-филы, как N-3, I-, Вr-
и нек-рые другие реагируют с Н.о. по атому углерода (поэтому Н.о. могут быть
алкилирую-щими агентами).
Алкилнитраты, как правило,
устойчивы к действию к-т, однако в присут. каталитич. кол-в H2SO4
может происходить переэтерификация; напр., при кипячении с СН3СООН
образуются ацетаты. Восстановление алкилнитратов разл. реагентами (FeCl2,
LiAlH4, N2H4, H2 на Ni-Ренея и др.)
приводит к соответствующим спиртам с высоким, иногда количеств. выходом, что
позволяет использовать группу ONO2 для защиты группы ОН в стероидах
и углеводах.
Ацилнитраты при нагр. отщепляют
СО2 и превращаются в нитросоед., при действии спиртов подвергаются
соль-волизу с образованием алкилнитратов, присоединяются к олефинам, давая сложные
эфиры b-нитроспиртов и др. продукты.
В пром-сти алкилнитраты
получают этерификацией спиртов конц. HNO3, смесью HNO3
и H2SO4 или HNO3 в (СН3СО)2О
(для стабилизации Н. о. добавляют мочевину), в лаборатории - р-цией алкилгалогенидов
с AgNO3, алкоголи-зом ацилнитратов или тетрафторобората нитрония
NO2BF4, действием N2O4 на алкиламины
в ТГФ при т-ре от -70 до -
80 °С. Для получения алкилнитратов можно использовать также р-цию алкилхлоркарбоната
ROCOCl с AgNO3 в пиридине, для получения Н. о. с аллильными, бензильными,
первичными и вторичными алкильными радикалами -р-цию соответствующих бромидов
с HgNO3 в глиме, для получения 1,2- и 1,3-динитратов-окисление алкенов
и циклопропанов Tl(NO3)3 в пентане, напр.:
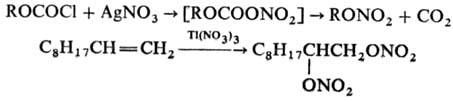
Ацилнитраты получают действием
HNO3 на ангидриды соответствующих к-т.
Для количеств. определения
H.о. обрабатывают H2SO4, образующуюся HNO3
разлагают действием Hg в H2SO4 и измеряют объем выделившегося
NO.
Н. о. применяют в орг.
синтезе; многие Н. о., содержащие активный кислород,-ВВ, напр. пентаэритриттетранитрат
(ТЭН), диэтанолнитраминдинитрат
(ДИНА). Н. о. используют также в качестве
компонентов бездымных порохов и ракетных топлив, добавок к дизельным топливам
(для повышения цетанового числа). Нитроглицерин и другие Н. о. полиолов используют
в медицине как антиангинальные (сосудорасширяющие) препараты.
Н. о. токсичны. Вдыхание
паров, попадание на кожу и в пищеварит. тракт вызывает головную боль, учащенное
сердцебиение. Н. о. окисляют гемоглобин в метгемоглобин.
Мировое произ-во H.о.-сотни
тыс. т в год. Обращение с Н. о. строго регламентировано, а транспортировка таких
Н. о., как нитроглицерин, нитрогликоль и др. в чистом виде запрещена в большинстве
стран.
См. также Диэтиленгликольдинитрат
,
Нитроглицерин
, Целлюлозы нитраты
, Этиленгликолъдинитрат.
Лит.: Андреев К.
К., Термическое разложение и горение взрывчатых веществ, М.-Л., 1957; Общая
органическая химия, пер. с англ., т. 3, М., 1982, с. 445-49; Houben-Weyl, Methoden
der organischen Chemie, Bd 6, Tl 2, Stuttg., 1963, S. 325-62. С.Л. Иоффе.
|

