ЭЛЕКТРОДЫ СРАВНЕНИЯ
, электрохим.
системы, предназначенные для измерения электродных потенциалов
. Необходимость
их использования обусловлена невозможностью измерения абс. величины потенциала
отдельного электрода. В принципе в качестве Э. с. может служить любой электрод
в термодинамически равновесном состоянии, удовлетворяющий требованиям воспроизводимости,
постоянства во времени всех характеристик и относит, простоты изготовления.
Для водных электролитов наиб, часто применяют в качестве Э. с. водородный,
каломельный, галогеносеребряные, оксидно-ртутный и хингидронный электроды.
Водородный Э. с. представляет собой кусочек
платиновой фольги или сетки, покрытый слоем электролитич. Pt и погруженный
частично в р-р, через к-рый пропускают Н2. При адсорбции на
электроде образуются адсорбир. атомы Надс. Электродные р-ции
на водородном Э. с. описываются ур-ниями: Н2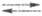 2Надс
2Надс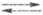 2Н+
+ 2е (е - электрон). Водородный электрод при давлении водорода рН2
равном 1 атм (1,01 х 105 Па), термодинамич. активности ионов
водорода в р-ре аН+, равной 1, наз. стандартным водородным
электродом, а его потенциал условно принимают равным нулю. Потенциалы других
электродов, отнесенные к стандартному водородному электроду, составляют
шкалу стандартных электродных потенциалов (см. Стандартный потенциал
).
Дня
водородного Э. с. Нернста уравнение
записывается в виде:
2Н+
+ 2е (е - электрон). Водородный электрод при давлении водорода рН2
равном 1 атм (1,01 х 105 Па), термодинамич. активности ионов
водорода в р-ре аН+, равной 1, наз. стандартным водородным
электродом, а его потенциал условно принимают равным нулю. Потенциалы других
электродов, отнесенные к стандартному водородному электроду, составляют
шкалу стандартных электродных потенциалов (см. Стандартный потенциал
).
Дня
водородного Э. с. Нернста уравнение
записывается в виде:
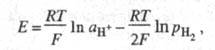
где Т - абс. т-ра;
F - постоянная
Фарадея; R - газовая постоянная. При рН2 = 1 атм электродный потенциал
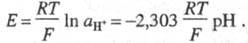
Используется в широком диапазоне рН - от
значений, соответствующим конц. к-там, до значений, соответствующим конц.
щелочам. Однако в нейтральных р-рах водородный Э. с. может нормально функционировать
лишь при условии, что р-р обладает достаточно хорошими буферными св-вами
(см. Буферный раствор
). Это связано с тем, что при установлении
равновесного потенциала на платинированной платине, а также при пропускании
тока через водородный Э. с. появляется (или исчезает) нек-рое кол-во ионов
Н+, т. е. изменяется рН р-ра, что особенно заметно в нейтральных
средах. Водородный электрод применяют в широком интервале т-р, отвечающем
существованию водных р-ров. Следует, однако, учитывать, что при повышении
т-ры парциальное давление водорода падает вследствие роста давления паров
р-рителя и обусловленное этим изменение потенциала Э. с. соответствует
ур-нию
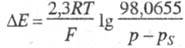 , где р -
барометрич. давление (в кПа), a ps - суммарное
давление насыщ. паров над р-ром (кПа). Возможность использования водородного
электрода в орг. средах требует спец. проверки, т. к. Pt может катализировать
процессы с участием орг. соед., вследствие чего нарушается равновесие электродной
р-ции и электрод приобретает стационарный потенциал, отличный от равновесного.
, где р -
барометрич. давление (в кПа), a ps - суммарное
давление насыщ. паров над р-ром (кПа). Возможность использования водородного
электрода в орг. средах требует спец. проверки, т. к. Pt может катализировать
процессы с участием орг. соед., вследствие чего нарушается равновесие электродной
р-ции и электрод приобретает стационарный потенциал, отличный от равновесного.
Каломельный Э. с. изготавливают, используя
ртуть и р-ры каломели в хлориде калия. Электродная р-ция на этом электроде
отвечает ур-нию: 2Hg + 2Сl-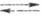 Hg2Cl2, а соответствующее ур-ние Нернста имеет вид:
Hg2Cl2, а соответствующее ур-ние Нернста имеет вид:
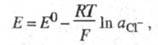
где E0 - стандартный
потенциал. В зависимости от концентрации КС1 различают насыщенный, нормальный
и децинормальный каломельные Э. с. Эти Э. с. хорошо воспроизводимы, устойчивы
и пригодны для работы при т-рах до 80 °С. При более высоких т-рах начинается
разложение хлорида ртути. Часто каломельный Э. с. подсоединяют через солевой
мостик, состоящий из концентриров. р-ра КС1 для снижения
диффузионного потенциала
. Потенциал Е каломельного Э. с. зависит от т-ры,
причем температурный коэф. минимален для децинормального электрода, для
к-рого Е =0,3365 - 6 х 10-5(t-25), где t -
т-ра (°С).
Галогеносеребряные Э. с. представляют
собой серебряную проволоку, покрытую галогенидом серебра, к-рый наносится
путем термич. или электрохим. разложения соли серебра. Электродная р-ция
отвечает ур-нию: Ag + Hal-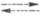 AgHal
+ е (Hal - галоген), а ур-ние Нернста имеет вид: .
AgHal
+ е (Hal - галоген), а ур-ние Нернста имеет вид: .
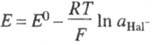
Удобны при работе с электрохим. ячейками
без жидкостного мостика, применимы как в водных, так и во мн. неводных
средах, устойчивы при повышенных т-рах. В области т-р 0-95 °С потенциал
хлорсеребряного Э. с. описывается ур-нием: E=0,23655-- 4,8564 x
10-4t - 3,4205 x 10-6t2
+ 5,869 x 10-9t3.
Оксидно-ртутный Э.с. приготавливают из
ртути и насыщенных р-ров оксида ртути в водном р-ре щелочи. Электродная
р-ция: Hg2O + 2e + H2O 2Hg + 2OH ;
2Hg + 2OH ;
ур-ние Нернста:
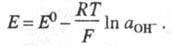
Удобен при работе в щелочных р-рах, т.
к. при этом легко реализовать цепи без жидкостного соединения.
Хингидронный Э. с. представляет собой
платиновую проволочку, опущенную в насыщ. р-р хингидрона. Электродная р-ция:
С6Н4(ОН)2 С6Н4О2 + 2Н+ + 2е. Стандартный
потенциал E° = 0,6992 В. Используется в интервале рН 0-6, а в буферных
р-рах в отсутствие сильных окислителей - до рН
С6Н4О2 + 2Н+ + 2е. Стандартный
потенциал E° = 0,6992 В. Используется в интервале рН 0-6, а в буферных
р-рах в отсутствие сильных окислителей - до рН 8,5.
В интервале т-р 0-50 °С потенциал хингидронного Э. с. выражается ур-нием:
Е = 0,6992 - 7,4 x 10-4(t -25) + [0,0591 + 2 x 10-4(t -25)] lgaН+ .
8,5.
В интервале т-р 0-50 °С потенциал хингидронного Э. с. выражается ур-нием:
Е = 0,6992 - 7,4 x 10-4(t -25) + [0,0591 + 2 x 10-4(t -25)] lgaН+ .
При измерениях в неводных средах в принципе
можно применять водные Э. с., если создать воспроизводимую границу водного
и неводного р-ров и учитывать возникающий на этой границе диффузионный
потенциал. Часто в неводных средах используют Э. с. на основе серебра в
р-ре его соли.
В расплавленных солевых системах наиболее
часто используются Э. с., основанные на паре AgI/Ag, к-рая стабильна в
разл. расплавах.
Потенциалы водных Э. с. по отношению к
стандартному водородному электроду при 25 °С приведены в табл.:
|
Электрод
|
Потенциал, В
|
|
Насыщенный каломельный:
Hg | Hg2Cl2, насыщенный КС1
|
0,2412
|
|
Нормальный каломельный:
Hg| Hg2Cl2, 1M КС1
|
0,2801
|
|
Децинормальный
каломельный: Hg| Hg2Cl2, 0,1M KC1
|
0,3337
|
|
Хлорсеребряный:
Ag | AgCl, насыщенный КС1
|
0,197
|
|
Оксидно-ртутный:
Hg| HgO, 0.1M NaOH
|
0,926
|
Лит.: Справочник по электрохимии,
под ред. A.M. Сухотина, Л., 1981; Практикум по электрохимии, под ред. Б.
Б. Дамаскина, М., 1991; Ives D. J. G., Janz G. J., Reference electrodes,
N. Y., 1961; Minh N. Q., Redey L., в кн.: Molten salt techniques, v. 3,
eds. D. C. Loverring, R.J. Gale, N. Y., 1984, p. 105-287.
О.А.Петрий.



 2Надс
2Надс 2Н+
+ 2е (е - электрон). Водородный электрод при давлении водорода рН2
равном 1 атм (1,01 х 105 Па), термодинамич. активности ионов
водорода в р-ре аН+, равной 1, наз. стандартным водородным
электродом, а его потенциал условно принимают равным нулю. Потенциалы других
электродов, отнесенные к стандартному водородному электроду, составляют
шкалу стандартных электродных потенциалов (см.
2Н+
+ 2е (е - электрон). Водородный электрод при давлении водорода рН2
равном 1 атм (1,01 х 105 Па), термодинамич. активности ионов
водорода в р-ре аН+, равной 1, наз. стандартным водородным
электродом, а его потенциал условно принимают равным нулю. Потенциалы других
электродов, отнесенные к стандартному водородному электроду, составляют
шкалу стандартных электродных потенциалов (см. 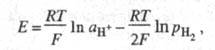
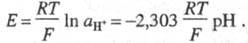
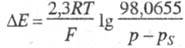 , где
, где  Hg2Cl2, а соответствующее ур-ние Нернста имеет вид:
Hg2Cl2, а соответствующее ур-ние Нернста имеет вид:
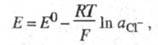
 AgHal
+ е (Hal - галоген), а ур-ние Нернста имеет вид: .
AgHal
+ е (Hal - галоген), а ур-ние Нернста имеет вид: .
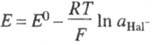
 2Hg + 2OH ;
2Hg + 2OH ;
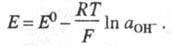
 С6Н4О2 + 2Н+ + 2е. Стандартный
потенциал E° = 0,6992 В. Используется в интервале рН 0-6, а в буферных
р-рах в отсутствие сильных окислителей - до рН
С6Н4О2 + 2Н+ + 2е. Стандартный
потенциал E° = 0,6992 В. Используется в интервале рН 0-6, а в буферных
р-рах в отсутствие сильных окислителей - до рН 8,5.
В интервале т-р 0-50 °С потенциал хингидронного Э. с. выражается ур-нием:
Е = 0,6992 - 7,4 x 10-4(t -25) + [0,0591 + 2 x 10-4(t -25)] lgaН+ .
8,5.
В интервале т-р 0-50 °С потенциал хингидронного Э. с. выражается ур-нием:
Е = 0,6992 - 7,4 x 10-4(t -25) + [0,0591 + 2 x 10-4(t -25)] lgaН+ .