НУКЛЕОЗИДЫ
, прир.
гликозиды, молекулы к-рых состоят из остатка пуринового или пиримидинового основания,
связанного через атом N с остатком D-рибозы или 2-дезок-си-D-рибозы в фуранозной
форме; в более широком смысле-прир. и синтетич. соед., в молекулах к-рых гетероцикл
через атом N или С связан с любым моносахаридом, иногда сильно модифицированным
(см. Минорные нуклеозиды
). В зависимости от входящих в молекулу остатков
моносахари-да и гетероциклич. основания различают рибо- и дезокси-рибонуклеозиды,
пуриновые и пиримидиновые Н.
Канонические Н. (см.рис.)-аденозин
(сокращенно А), гуанозин (G), цитидин (С), их 2-дезоксианалоги, а также тимидин
(Т) и уридин (U)-являются компонентами нуклеиновых кислот
. В природе
Н. встречаются также в своб. состоянии (преим. в виде нуклеозидных антибиотиков
).
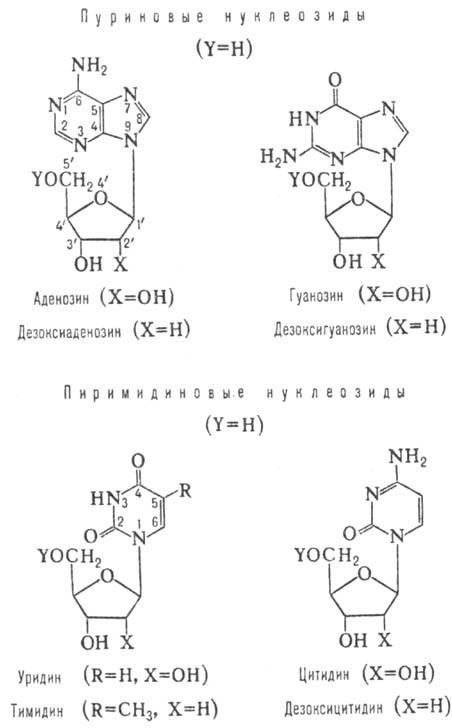
Основные нуклеозиды,
входящие в состав нуклеиновых к-т.
Основаниям в составе Н.
в кристаллич. состоянии отвечают таутомерные формы, к-рые приведены в ф-лах.
Экзо-циклич. группа NH2 частично двоесвязана, что проявляется в укорачивании
связи С—N и отсутствии свободы вращения относительно нее. В р-ре в незначит.
кол-вах присутствуют и др. таутомерные формы.
Основания и связанные с
ними атомы практически копла-нарны. Кольцо дезоксирибозы в составе Н. всегда
неплоское и обычно находится в С2- или С3-эндо
-конформации
(атом С соотв. в положении 2 или 3 располагается над фуранозным кольцом).
В р-ре эти конформации находятся в динамич. равновесии. Их взаимное превращ.
происходит через О4-эндо
-конформацию; положение равновесия
определяется природой заместителей при атомах в положениях С-2 и С-3.
Все природные Н. имеют
b-конфигурацию N-гликозидной связи. Вращение гетероциклич. основания относительно
этой связи в принципе свободное, однако сочетание ряда стабилизирующих факторов
приводит к предпочтительной анти
-ориентации в случае пиримидиновых Н.
(атом О-2 направлен
в сторону от сахара), тогда как пуриновые Н. встречаются как в син-
, так
и в анти
-конформации (имида-зольное кольцо направлено соотв. в сторону
сахара и от него); исключение составляет гуанозин, для к-рого характерна син
-конформация.
Н.-кристаллич. в-ва, имеют
характерные рН-зависимые УФ спектры (см. табл.). Обладают слабыми основными
св-вами; их разл. склонность к протонированию (убывает в ряду: C>G>A>T
= U) используют для разделения Н. методами ионообменной хроматографии и электрофореза.
НЕКОТОРЫЕ ФИЗИКО-ХИМИЧЕСКИЕ
СВОЙСТВА НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ НУКЛЕОЗИДОВ
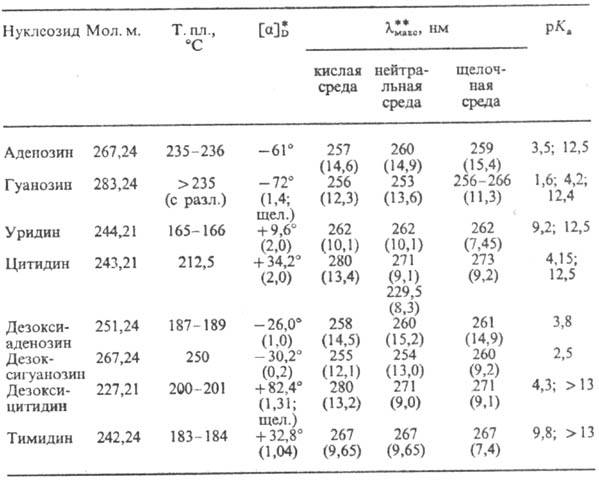
* В скобках приводится
концентрация Н. в воде, % по массе;
щел.-щелочная среда. ** В скобках приводится значение
e (в тыс. ед.).
Хим. св-ва Н. определяются
прежде всего природой углеводного и гетероциклических остатков. При действии
HNO2 происходит дезаминирование, в результате чего экзоциклич. аминогруппа
превращ. в оксо- или енольную ф-цию (в результате таутомерии); аналогичные превращ.
происходят при действии ферментов
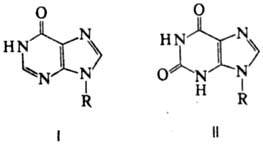
нуклеозиддезами наз. При этом из цитидина образуется
у р и д и н, из аденозина-и н о з и н, или р и б о к с и н (ф-ла I, R-остаток
рибозы; т. пл. 218°С, [a]D18 -49,2° при концентрации
0,91% в воде; lмакс 248,5 нм, e 12200), из г у а н о з и н а-ксантозин
(ф-ла II, R-остаток рибозы; т. пл. > 300 °С-с разл., [a]D30-51,2°
при концентрации 1% в 0,1 н. водном р-ре NaOH; lмакс 253 нм, e 8790).
Следует также отметить
ацилирование (в т.ч. фосфори-лирование) и алкилирование остатков моносахарида
по гидроксилам; N- и О-алкилирование по гетероциклич. основаниям (преим. в положения
3,4 пиримидинов и 6,7 пуринов); замены гидроксилов остатка моносахарида на разл.
атомы и группы (Н, Hal, NH2, N3 и др.); присоединение
по 5,6-двойной связи пиримидинов (гидрирование, гидроксилирование, присоединение
бисульфита и др. нуклеофилов); галогенирование (в т.ч. фторирование) и металлирование
(гл. обр. получение Li-производных) пиримидинов в положение 5 с послед. заменой
металла на разл. группы (преим. алкильные); аналогичное галогенирование с послед.
замещением в положении 8 пуринов; 5-гидроксиметилирование с послед. превращ.
СН2ОН в карбоксил и его дериватизацией; раскрытие пиримидинового
кольца под действием гидразина или гидроксиламина; образование N-оксидов, дестабилизирующее
гетероциклич. ядро; периодатное расщепление 2,3-гликольной группировки остатка
рибозы с образованием высокореакционноспособного диальдегида; катализируемое
к-тами расщепление N-гликозидной связи (наиб. чувствительны при этом пуриновые
Н. дезоксиряда). Нек-рые св-ва Н. определяются сочетанием остатков моносахарида
и гетероцикла. Так, внутримол. нуклеоф. атака атома О в положении 2 пиримидина
по атому С в положении 2, 3 или 5 при наличии эффективной уходящей группы
(напр., тозильной) приводит к соответствующим трициклическим ангидронуклеозидам
- важным промежут. соед. в синтезе аналогов Н.
Природные Н. получают преим.
ферментативным гидролизом ДНК или щелочным гидролизом РНК с послед. ферментативным
дефосфорилированием образующейся смеси нуклеотидов (нуклеозидфосфатов) и хроматографич.
разделением. Существующие эффективные методы хим. синтеза используются гл. обр.
для получения неприродных Н., однако постепенно, становясь все более экономичными,
они распространяются на синтез природных Н. Обычно синтез Н. осуществляют взаимод.
пертриметилсилилир. основания с перацилир. моносахаридом или ацилгалогенозой
(глико-зидная группа ОН заменена на галоген, др. группы ОН ацилированы), оглавлением
основания с перацетилир. моносахаридом или же конденсацией основания с ацилгалогенозой
в присут. солей ртути. Др. путь синтеза-достройка гетероцикла в составе фрагмента,
содержащего рибозу, с использованием подходящего синтона (см. Органический синтез
); этот подход чаще всего используется в синтезе Н. с С-гликозидной
связью. Синтетически получено множество Н., модифицированных по основанию и
моносахариду (в т. ч. с линейной формой последнего вместо циклической), с a-конфигурацией
N-гликозидной связи и т.д.
Н. используют как исходные
в-ва в искусств. синтезе фрагментов ДНК (РНК) и синтезе нуклеотидов, в качестве
лигандов в аффинной хроматографии, в химиотерапии вирусных, онкологич. и нек-рых
др. заболеваний (напр., 3-азидо-3-дезокситимидин, или азидотимидин,- против
синдрома приобретенного иммунодефицита, рибоксин-при ишемической болезни сердца,
l-b-D-арабинофуранозилцито-зин, или цитарабин,-противоопухолевый препарат).
Лит.: Органическая
химия нуклеиновых кислот, М., 1970; Шабарова 3. А., Богданов А. А., Химия нуклеиновых
кислот и их компонентов, М., 1978; Nucleoside analogues. Chemistry, biology
and medical applications, ed. by R.T. Walker [a.o], N.Y.-L, 1979. Ю.А. Берлин.
|

