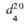|
Реклама |
|
|
 |
* рК3
15,6 (2-ОН). ** В 80%-ном 2-метоксиэтаноле. Тригидроксибензойные к-ты
при нагр. легко декарбокси-лируются; напр., 2,4,6-тригидроксибензойная к-та
превращ. в диангидрид - краситель флоротаннинрот, применяемый при крашении кожи
(см. также Галловая кислота
). О. к. с гидроксилъными
группами в орто-
или пара
-положе-нии к группе СООН получают карбоксилированием
соответствующих фенолятов щелочных металлов под действием СО2 при
120-220 °С и 0,5-1,2 МПа (р-ция Кольбе-Шмитта). При использовании фенолятов
Na и Li осн. продукт р-ции-орто
-изомер, фенолята К-пара
-изомер;
так, 4-гидроксибен-зойную к-ту получают карбоксилированием фенолята К (220 °С,
0,4-0,5 МПа) с выходом 80%. 3-Гидроксибензойную к-ту
получают щелочным плавлением Na-соли 3-карбоксибензолсульфокислоты (210-220
°С) или окислением 3-гидроксибензальдегида О2 воздуха в водно-щелочной
среде, а также исходя из эфира 3-нитробензой-ной к-ты, через стадии гидрирования
(кат.-Ni-Ренея), диазо-тирования образующегося эфира аминокислоты и разложения
соли диазония разб. H2SO4 (100 °С). Дигидроксибензойные к-ты
обычно получают карбоксилированием соответствующих фенолятов СО2
в водном р-ре Na2CO3. 3,4-Дигидроксибензойную к-ту синтезируют
также щелочным омылением 3-хлор- или З-бром-4-гидроксибен-зойной к-ты под действием
КОН (кат.-порошок Сu, 190-200 °С) или окислением ванилина Ag2O.
Щелочным плавлением 5-карбокси-1,3-бензолдисульфокислоты при 220-250° получают
3,5-дигидроксибензойную к-ту. Тригидроксибензойные к-ты
в виде сложных эфиров содержатся в таннинах
листьев чая, плодов граната,
чернильных орешков, дубовой коры; выделяют их щелочным или ферментативным гидролизом.
Синтезируют гл. обр. карбоксилированием соответствующих тригидроксибензолов
в водном р-ре КНСО3. 2,3,5-Тригидроксибензойную к-ту получают также
окислением 2-гидроксибензойной или 3,5-ди-гидроксибензойной к-ты K2S2O8
в водной щелочи. Цветные р-ции: с FeCl3
3,4,5-тригидроксибензойная к-та дает сине-черное окрашивание, 2,3,4-тригидроксибензой-ная-фиолетовое.
Табл. 2.-СВОЙСТВА ЭФИРОВ
4-ГИДРОКСИБЕНЗОЙНОЙ КИСЛОТЫ HOC6H4COOR
* Для фенола принята равной
единице. О.-промежут. продукты при
синтезе красителей, фарма-цевтич. препаратов, фотографич. материалов, косметич.
ср-в. Эфиры 3-гидрокси-, 4-гидрокси- и 3,4-дигидроксибен-зойных к-т обладают
бактерицидными св-вами и применяются в качестве консервантов для пищ. продуктов.
Наиб. применение находят эфиры 4-гидроксибензойной к-ты (табл. 2). 2,5-Дигидроксибензойная
к-та обладает противоревма-тич. действием. Лит.: Uilmanns Encyclopadie,
4 Aufl., Bd 13, Weinheim, 1977, S. 163-68. Н.Б.Карпова. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||