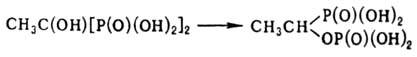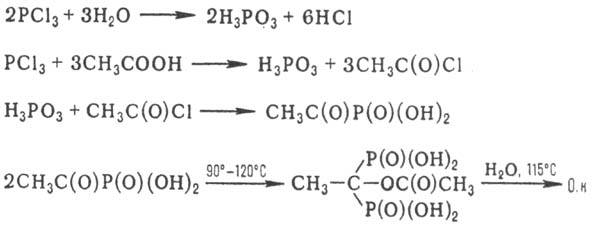ОКСИЭТИЛИДЕНДИФОСФОНОВАЯ КИСЛОТА
(1-гид-роксиэтан-1,1-дифосфоновая к-та) СН3С(ОН)[Р(О)(ОН)2]2,
мол. м. 206,03; бесцв. кристаллы; т. пл. 198-200 °С; 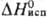 350 кДж/кг,
350 кДж/кг, 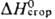 -1214
кДж/моль,
-1214
кДж/моль, 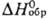 -2177 кДж/моль.
Р-римость (г/л): в воде-2300, этаноле-700, ДМФА-125, ДМСО-200, 30%-ной уксусной
к-те-1500; не раств. в ацетоне, углеводородах и алкилгалогенидах. В спектре
ЯМР 31Р хим. сдвиг 19,3 м.д. (относительно 85%-ной Н3РО4);
в спектре ПМР хим. сдвиг 1,35 м.д. (СН3). Константа спин-спинового
взаимод. для НССР 16 Гц.
-2177 кДж/моль.
Р-римость (г/л): в воде-2300, этаноле-700, ДМФА-125, ДМСО-200, 30%-ной уксусной
к-те-1500; не раств. в ацетоне, углеводородах и алкилгалогенидах. В спектре
ЯМР 31Р хим. сдвиг 19,3 м.д. (относительно 85%-ной Н3РО4);
в спектре ПМР хим. сдвиг 1,35 м.д. (СН3). Константа спин-спинового
взаимод. для НССР 16 Гц.
О. к.-сильная пятиосновная
к-та: рКа 1,7, 2,47, 7,28, 10,29 и 11,13. Разлагается при
т-ре ок. 250 °С (в водных р-рах разлагается при 140°С); с основаниями
образует соли. Избытком уксусного ангидрида ацетилируется по группе СОН; при
обработке диазаалканами образует тетраэфиры. При нагр. претерпевают фосфонат-фосфатную
перегруппировку:
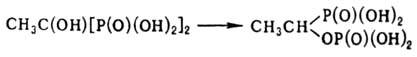
Образует устойчивые комплексы
(см. табл.) с катионами РЗЭ, щел.-зем. и переходных элементов (в т.ч. в сильно
кислых средах).
В пром-сти О. получают
по схеме:
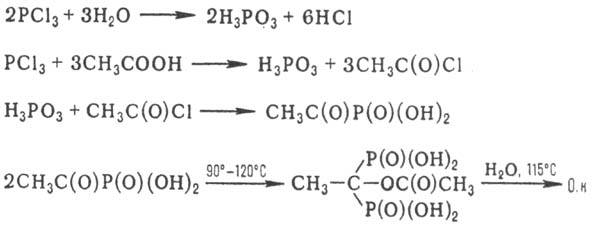
Процесс осуществляют в
периодич. или непрерывном режиме. В качестве побочных продуктов в незначит.
кол-вах образуются фосфорсодержащие олигомеры и полимеры. Выход О. к. достигает
ок. 80%. Выход повышается в присут. (СН3СО)2О.
O.к. может быть также получена:
окислением Р под давлением в присут. CH3COOH; взаимод. СН3СООН
с Р4Об или смесью Р4Об/Н3РО3;
р-цией (СН3СО)2О,
ЛОГАРИФМЫ КОНСТАНТ УСТОЙЧИВОСТИ
КОМПЛЕКСОВ ОКСИЭТИЛИДЕНФОСФОНОВОЙ
КИСЛОТЫ С НЕКОТОРЫМИ МЕТАЛЛАМИ (М-металл. L-лиганд)
|
|
Логарифм константы
устойчивости комплекса
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
СН3СОСl или
СН2=С=О с Н3РО3; взаимод. кислых фосфитов или
их солей с СН3СОХ(Х = Сl, ОСН=СН2, СН3СОО)
с послед, кислотным гидролизом образующихся на первой стадии эфиров CH3C(OH)[PO(OR)2]2.
O.к. используют в нефтедобывающей
пром-сти и теплоэнергетике (добавки О. к. предотвращают отложение солей в котлах
и трубопроводах), в с. х-ве (регулятор роста зерновых и зернобобовых), в парфюмерии
и косметике (стабилизатор изделий), в бытовой химии (входит в состав препаратов
для отбеливания, удаления накипи и пятен), в аналит. химии (титрант и маскирующий
агент при анализе РЗЭ).
O.к. хорошо горит, т. самовоспл.
220°С (аэрогель) и 338 °С (аэрозоль).
Лит.: Кабачник М.
И. [и др.], "Хим. пром-сть", 1975, № 4, с. 254-58; Кабачник М. И.,
"Ж. Всес. хим. об-ва им. Д.И.Менделеева", 1984, т. 29, № з, с. 32-42;
Дятлова Н. М., там же, с. 7-20. Г.И. Дрозд.



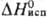 350 кДж/кг,
350 кДж/кг, 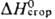 -1214
кДж/моль,
-1214
кДж/моль, 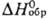 -2177 кДж/моль.
Р-римость (г/л): в воде-2300, этаноле-700, ДМФА-125, ДМСО-200, 30%-ной уксусной
к-те-1500; не раств. в ацетоне, углеводородах и алкилгалогенидах. В спектре
ЯМР 31Р хим. сдвиг 19,3 м.д. (относительно 85%-ной Н3РО4);
в спектре ПМР хим. сдвиг 1,35 м.д. (СН3). Константа спин-спинового
взаимод. для НССР 16 Гц.
-2177 кДж/моль.
Р-римость (г/л): в воде-2300, этаноле-700, ДМФА-125, ДМСО-200, 30%-ной уксусной
к-те-1500; не раств. в ацетоне, углеводородах и алкилгалогенидах. В спектре
ЯМР 31Р хим. сдвиг 19,3 м.д. (относительно 85%-ной Н3РО4);
в спектре ПМР хим. сдвиг 1,35 м.д. (СН3). Константа спин-спинового
взаимод. для НССР 16 Гц.