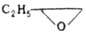
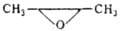
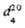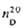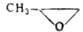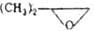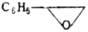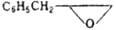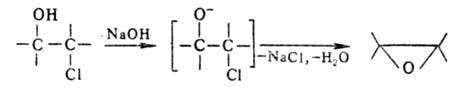|
Реклама |
|
|
 |
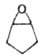
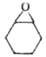
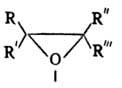
Хим. св-ва О. о. определяются
их высокой реакц. способностью, связанной с относит, легкостью размыкания напряженного
3-членного цикла. Для О. о. характерны р-ции присоединения, протекающие с разрывом
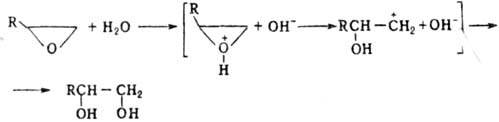
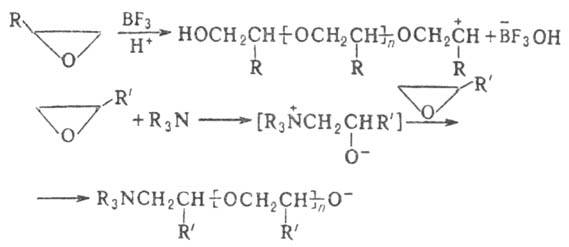
цикла гл. обр. по связи С—О. Так, нагревание О. о. с водой в присут. кислотных
и основных катализаторов протекает с образованием гликолей. В первом случае
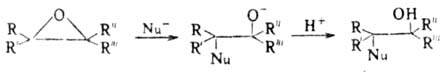
оно идет через промежут. оксониевый катион: При нуклеоф. атаке р-ция
идет через промежут. алкоксид-ный анион с послед. присоединением протона: При этом направление атаки
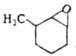
зависит от кислотности среды. Так, для алкилзамещенных О. о. в кислой среде
атака идет по наиб. замещенному атому С, в основной или нейтральной
- по наим. замещенному. Стереоселективность раскрытия цикла зависит также от
стерич. факторов и полярности р-рителя. С галогеноводородами О.
о. образуют галогенгидри-ны, со спиртами-простые эфиры гликолей, с NH3
и аминами - аминоспирты. О. о. при нагр. или в присут.
нек-рых катализаторов изомеризуются в альдегиды или кетоны. Так, при изомеризации
этиленоксида образуется ацетальдегид, при изомеризации пропиленоксида - смесь
пропионового альдегида, ацетона и аллилового спирта. Соотношение продуктов зависит
от условий р-ции: при 240-280 °С в присут. паров воды, SiO2,
Аl2О3 или квасцов в реакц. смеси содержится ок. 85% пропионового
альдегида; при катализе Li3PO4 при 250 °С содержание
аллилового спирта увеличивается. При восстановлении LiAlH4
обычно преобладает атака по наим. замещенному атому оксиранового цикла. Над
никелевыми и др. катализаторами при большом избытке Н2 с добавлением
до 10% водяного пара идет гидрирование в соответствующий вторичный спирт. О. о. при нагр. в присут.
катализаторов катионной и анионной полимеризации (напр., металлоорг. соед.,
щелочей, аминов, к-т Льюиса и т.д.) превращаются в простые полиэфиры (см. также Полиэтиленоксид
), напр.: Наиб. высокомол. полимеры
образуются при анионной полимеризации в присут. гетерог. катализаторов-щел.-зем.
металлов, оксидов Mg, Be, амидов, карбонатов и сульфатов Са, Sr и Ва. Получают О. о. эпоксидированием -
гл. обр. окислением олефинов орг. надкислотами (надуксусной, надпропионовой
и др.) по Прилежаева реакции
. Эпоксидирование олефинов осуществляют иногда
с использованием гидропероксидов этилбензола, изопропилбензола в присут. более
легко окисляемых соед., напр, альдегидов. В последнем случае активный кислород
окисляет альдегид в пероксид, реагирующий затем с олефином. В пром. масштабе
эти методы используют для получения пропиленоксида
. Применяют также и др. методы
эпоксидирования, напр. Дарзана реакцию
и циклодегидрогалогенирование
a-хлор-гидринов под действием щелочей: Др. препаративные методы
получения О.о.-дегидратация а-гликолей, конденсация диазометана с кетонами или
альдегидами. Особое место занимает гетерог. окисление этилена на серебряном
катализаторе, используемое как пром. способ получения этиленоксида. В пром.
масштабе получают также оксиды стирола и бутилена. Токсичность низших О. о.
значительна и, как правило, снижается с увеличением мол. массы. О. о. - исходные в-ва для
получения эпоксидных смол, полимеров, ряда лек. препаратов; применяются в орг.
синтезе. Лит.: Малиновский
М. С., Окиси олефинов и их производные, М., 1961; Общая органическая химия,
пер. с англ., т. 2, М., 1982, с. 376-391; Comprehensive heterocyclic chemistry,
ed. by A. R. Katrizky, v. 7, N. Y.-[a. o.], 1984, p. 95-129; Kirk-Olhmer encyclopedia,
3 ed., v. 9, N.Y., 1980, p. 251-56. Б.Б. Чесноков. |

 6,27·10-30 Кл·м.
6,27·10-30 Кл·м.