ОНИЕВЫЕ СОЕДИНЕНИЯ
,
солеобразные соед. общей ф-лы Rn +1 Э+Х-
, в к-рых атом элемента Va-VIIa подгрупп периодич. системы с единичным положит.
зарядом О) связан максимально возможным числом ковалентных связей с орг. остатком
и(или) атомом водорода (R) и ионной связью с анионом X (X = Hal, ОН, BF4,
NO3 и др.; n-низшая степень окисления элемента). К О. с. относятся
соед. типов R4Э+X-
(Э = N, P, As, Sb, Bi), R3Э+X- (Э = O, S, Se,
Те) и R2Э+X- (Э = Сl, Br, I).
Стабильность О. с. уменьшается
при переходе от элементов V гр. к элементам VII гр. периодич. системы. Р-ры
О. с. в воде электропроводны. Гидроксиды О.с. (X = ОН)-сильные основания, при
термолизе образуют олефины (при Э = N, S, Se, Те) или алканы (при Э = P, As,
Sb), напр.:
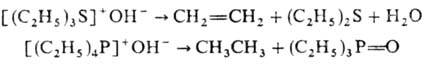
Наиб. общий метод получения
алифатических О. с.-алки-лирование алкилгалогенидами или алкилтозилатами их
предшественников (алкилпронзводных, содержащих на один алкильный остаток меньше,
чем соответствующее О. с.), напр.: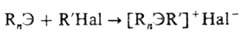
В случае малостабильных
оксониевых и особенно галоген-ониевых соед. р-цию проводят в присут. BF3
или SbF5 при полном отсутствии влаги. Общий способ получения ароматических
О. с.-термолиз тетрафтороборатов арилдиазониев (или арилгалогенониев) в среде
их предшественников (соед. общей ф-лы АrnЭ), напр.:
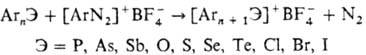
О. с. Bi, Те и I можно
получить протолитич. отщеплением одного арильного остатка от их ароматич. производных
более высокой степени окисления:
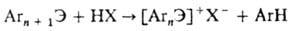
Для каждого типа О. с.
существуют специфич. методы синтеза, рассматриваемые в соответствующих статьях.
Почти все О. с. обладают
физиол. активностью. Ониевые структуры входят в состав мн. прир. и биологически
важных соед. (бетаины, холин и ацетилхолин, лек. ср-ва и др.). О. с., содержащие
радикалы с длинной углеродной цепью, обладают поверхностной активностью и применяются
как нейтральные мыла; нек-рые из них-катализаторы межфазного переноса. О. с.-промежут.
продукты ряда орг. р-ций и перегруппировок (напр., Арбузова реакция
, Виттига реакция
, Гофмана реакции
). К О. с. относятся мн. орг. красители. См. также Аммониевые соединения
, Галогенониевые соединения
, Оксониевые соединения
,
Фосфониевые соединения
.
Т. П. Толстая.
|

