ОРБИТАЛЬ
(от лат.
orbita-путь, колея), волновая ф-ция, описывающая состояние одного электрона
в атоме, молекуле или др. квантовой системе. В общем случае квантовохим. термин
"О." используется для любой ф-ции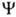 ,
зависящей от переменных х, у, z одного электрона. В рамках молекулярных орбиталей методов
для электронных состояний молекул часто используют приближенное
описание квантовой системы как целого, задавая состояние электрона в усредненном
поле, созданном ядрами и остальными электронами системы. При этом О.
,
зависящей от переменных х, у, z одного электрона. В рамках молекулярных орбиталей методов
для электронных состояний молекул часто используют приближенное
описание квантовой системы как целого, задавая состояние электрона в усредненном
поле, созданном ядрами и остальными электронами системы. При этом О.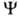 определяется
одноэлектронным ур-ни-ем Шрёдингера [Шредингера] с эффективным одноэлектронным гамильтонианом
определяется
одноэлектронным ур-ни-ем Шрёдингера [Шредингера] с эффективным одноэлектронным гамильтонианом
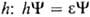 ; орбитальная
энергия
; орбитальная
энергия 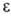 ,
как правило, соотносится с потенциалом ионизации (см. Купманса теорема
).
В зависимости от системы, для к-рой определена О., различают атомные, молекулярные
и кристаллические О.
,
как правило, соотносится с потенциалом ионизации (см. Купманса теорема
).
В зависимости от системы, для к-рой определена О., различают атомные, молекулярные
и кристаллические О.
Атомные О. (АО) характеризуются
тремя квантовыми числами: главным п, орбитальным / и магнитным ш. Значение
l = 0, 1, 2,... задает квадрат орбитального (углового) момента электрона
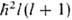 (
(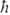 -постоянная
Планка), значение m = l,l — 1,..., +1, 0, — 1,..., — l
+ 1, — l-проекцию момента на нек-рую выбранную ось z; n нумерует
орбитальные энергии. Состояния с заданным / нумеруются числами п = l
+ 1, l + 2,... В сферич. системе координат с центром на ядре атома АО
имеет форму
-постоянная
Планка), значение m = l,l — 1,..., +1, 0, — 1,..., — l
+ 1, — l-проекцию момента на нек-рую выбранную ось z; n нумерует
орбитальные энергии. Состояния с заданным / нумеруются числами п = l
+ 1, l + 2,... В сферич. системе координат с центром на ядре атома АО
имеет форму 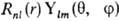 ,
где
,
где 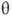 и
и
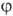 -полярные углы, r-расстояние от электрона до ядра. Rnl(r)наз. радиальной частью АО (радиальной ф-цией), a Ylm(q,
j)-сферич. гармоникой. При поворотах системы координат сферич. гармоника заменяется
на линейную комбинацию гармоник с одним и тем же значением l; радиальная
часть АО при поворотах не меняется, и соответствующий этой АО энергетич. уровень
(21 + 1)-кратно вырожден. Обычно
-полярные углы, r-расстояние от электрона до ядра. Rnl(r)наз. радиальной частью АО (радиальной ф-цией), a Ylm(q,
j)-сферич. гармоникой. При поворотах системы координат сферич. гармоника заменяется
на линейную комбинацию гармоник с одним и тем же значением l; радиальная
часть АО при поворотах не меняется, и соответствующий этой АО энергетич. уровень
(21 + 1)-кратно вырожден. Обычно  - показатель орбитальной экспоненты, а Рпl- полином степени
(п — l — 1). В сокращенной записи АО описывают символом nlm,
причем п обозначают цифрами 1, 2, 3,..., значениям l = 0, 1, 2,
3, 4,... отвечают буквы s, p, d, f, g,...; m указывают
справа внизу, напр. 2p+1, 3d-2
.
- показатель орбитальной экспоненты, а Рпl- полином степени
(п — l — 1). В сокращенной записи АО описывают символом nlm,
причем п обозначают цифрами 1, 2, 3,..., значениям l = 0, 1, 2,
3, 4,... отвечают буквы s, p, d, f, g,...; m указывают
справа внизу, напр. 2p+1, 3d-2
.
Более удобны АО, содержащие
не комплексные сферич. гармоники, а их линейные комбинации, имеющие веществ.
значения. Такие АО наз. кубическими (тессераль-ными). Они имеют вид 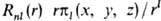 , где
, где 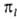 (х,
y, z) - однородный полином (угловая ф-ция) степени l относительно
декартовых координат электрона х, у, z с центром на ядре (направление
осей произвольно); АО обозначают символами
(х,
y, z) - однородный полином (угловая ф-ция) степени l относительно
декартовых координат электрона х, у, z с центром на ядре (направление
осей произвольно); АО обозначают символами 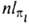 ,
напр.
,
напр.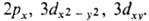
Если полином Pnl(r)определяется решением ур-ния Шрёдингера [Шредингера] для электрона в кулоновском поле
ядра, АО наз. водородоподобными. Наиб. употребительные водоро-доподобные кубич.
АО приведены в таблице.
ВОДОРОДОПОДОБНЫЕ ОРБИТАЛИ
s. p, d, f-ТИПОВ
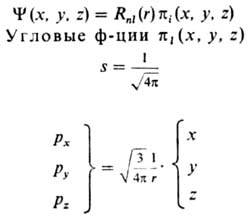

В хим. приложениях нередко
приводят контуры АО, к-рые м. б. построены по-разному. Наиб. распространены
т. наз. фазовые пов-сти, на к-рых изображают значения кубич. (или сферич.) гармоник:
при заданных полярных углах модуль угловой части АО равен расстоянию до начала
координат. На рис. 1 приведены другие, более наглядные пов-сти, на к-рых абс.
величины нек-рых АО имеют постоянное значение. Оба способа изображения АО практически
не различаются лишь вблизи начала координат. Во всех случаях знаками + и — (или
штриховкой) указывают, какой знак имеет АО в данной области. Как и все волновые
ф-ции, АО можно умножить на — 1, что приведет к изменению знака
ф-ции, однако смысл имеют не знаки АО сами по себе, а
чередование знаков для системы АО при описании мол. орбиталей. Графич. изображение
АО не всегда имеет смысл. Так, квадраты модулей сферич. гармоник не зависят
от угла  , поэтому изображение, напр., АО 2рх и 2ру будет
совсем не похоже на изображение АО 2р+ и 2p-,
хотя обе пары АО полностью эквивалентны.
, поэтому изображение, напр., АО 2рх и 2ру будет
совсем не похоже на изображение АО 2р+ и 2p-,
хотя обе пары АО полностью эквивалентны.

Молекулярные О. (МО)
описывают электрон в поле всех ядер молекулы и усредненном поле остальных электронов.
Как правило, МО не имеют простого аналит. представления и для них используют
приближение линейной комбинации атомных орбиталей (см. ЛКАО-приближение
).
В методах мол. орбиталей многоэлектронная волновая ф-ция строится как произведение
или определитель, составленный из спин-орбиталей, т.е. О., умноженных на спин-функцию
 или
или 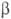 (см. Паули принцип
).
(см. Паули принцип
).
Для молекул с симметричной
ядерной конфигурацией МО классифицируют по типам симметрии. Напр., МО любой
молекулы с аксиальной симметрией, в т. ч. двухатомной молекулы, можно классифицировать
по поведению относительно поворотов вокруг оси молекулы (как правило, оси z).
Если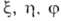 -набор координат электрона, напр. цилиндрических, в к-ром выделен угол
-набор координат электрона, напр. цилиндрических, в к-ром выделен угол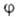 поворота вокруг оси, все МО можно представить в форме
поворота вокруг оси, все МО можно представить в форме 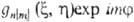 ,
где т = 0, b 1, b2, b3,..., а п нумерует
орбитальные энергии (п = 1, 2, 3...). При т — 0 такая О. не меняется
при поворотах и наз. s-орбиталью.
При m
,
где т = 0, b 1, b2, b3,..., а п нумерует
орбитальные энергии (п = 1, 2, 3...). При т — 0 такая О. не меняется
при поворотах и наз. s-орбиталью.
При m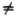 0 уровни
с одинаковыми значениями
0 уровни
с одинаковыми значениями 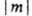 двукратно вырождены. По аналогии с АО принято обозначать МО символами
двукратно вырождены. По аналогии с АО принято обозначать МО символами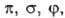 ..., если они отвечают
..., если они отвечают 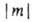 = 1, 2, 3... Аксиальносимметричные МО обозначают символами
= 1, 2, 3... Аксиальносимметричные МО обозначают символами 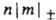 (справа внизу указывают знак т), напр. 2
(справа внизу указывают знак т), напр. 2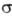 ,1
,1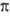 +,
2
+,
2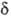 -.
Как и в случае атомов, нередко используются вещественнозначные формы МО, в к-рых
зависимость от j описывается простыми ф-циями декартовых координат. Соответственно
возникают МО типа
-.
Как и в случае атомов, нередко используются вещественнозначные формы МО, в к-рых
зависимость от j описывается простыми ф-циями декартовых координат. Соответственно
возникают МО типа 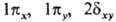 и т.д. Гомоядерная молекула имеет дополнительно центр инверсии; МО, не меняющие
при инверсии знак, наз. ч е т н ы м и, а меняющие-нечетными; четность МО указывается
ниж. индексами g (четная) или и (нечетная).
и т.д. Гомоядерная молекула имеет дополнительно центр инверсии; МО, не меняющие
при инверсии знак, наз. ч е т н ы м и, а меняющие-нечетными; четность МО указывается
ниж. индексами g (четная) или и (нечетная).
В многоатомной молекуле
симметричность ядерной конфигурации отражается в том, что при повороте вокруг
главной оси симметрии орбитали либо не меняются (МО типа а), либо
меняют знак (МО типа b) Симметричность или антисимметричность
относительно отражения в плоскости, содержащей главную ось, либо относительно
поворота вокруг оси 2-го порядка, перпендикулярной главной оси симметрии, указывают
ниж. индексами 1 или 2 соотв., а в случае плоскости, перпендикулярной оси,-одним
или двумя штрихами. Симметрия относительно инверсии указывается ниж. индексами
д и и, как и для двухатомных молекул. Напр., в молекуле с симметрией
D4h орбиталь 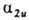 симметрична относительно поворота вокруг главной оси 4-го порядка, антисимметрична
относительно поворота вокруг перпендикулярной оси 2-го порядка и относительно
инверсии. Если при поворотах МО переходит в комбинацию двух (или трех) МО, как
это имеет место для МО типа
симметрична относительно поворота вокруг главной оси 4-го порядка, антисимметрична
относительно поворота вокруг перпендикулярной оси 2-го порядка и относительно
инверсии. Если при поворотах МО переходит в комбинацию двух (или трех) МО, как
это имеет место для МО типа 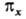 и
и  она обозначается
символом "e" (или f) с соответствующими индексами
(употребителен также символ t).
она обозначается
символом "e" (или f) с соответствующими индексами
(употребителен также символ t).
Изменение знака МО при
отражении в плоскости означает, что в этой плоскости МО обращается в нуль. С
ростом числа узловых плоскостей МО, вообще говоря, отвечает все более высоким
значениям орбитальных энергий.
Для систем, где имеются
локальные плоскости симметрии, напр. для молекул с ненасыщ. связями, МО обозначают
не так, как следовало бы для группы симметрии Сg т. е. не
a или а:, а используют обозначения, аналогичные обозначениям
МО двухатомных молекул: МО, симметричные относительно плоскости, обозначаются
как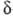 -орбитали,
а антисимметричные относительно плоскости - как
-орбитали,
а антисимметричные относительно плоскости - как 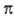 -орбитали.
Поскольку
-орбитали.
Поскольку 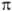 -орбитали
заведомо имеют плоскость симметрии, в к-рой они обращаются в нуль, орбитальные
энергии МО возрастают в ряду
-орбитали
заведомо имеют плоскость симметрии, в к-рой они обращаются в нуль, орбитальные
энергии МО возрастают в ряду 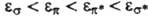 , где * означает разрыхляющую орбиталь (см. ниже). Орбитали, отвечающие неподеленной
паре электронов, обозначаются как п.
, где * означает разрыхляющую орбиталь (см. ниже). Орбитали, отвечающие неподеленной
паре электронов, обозначаются как п.
Под действием электромагн.
поля наиб. вероятны переходы с изменением состояния лишь одного из электронов,
поэтому при описании квантовых переходов
в сопряженных системах принято
указывать лишь символы соответствующих МО; напр., в ненасыщ. системах возможны
переходы 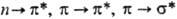 и
т.п.
и
т.п.
В рамках ЛКАО-приближения
МО можно связать с О. атомов, образующих молекулу. Если орбитальная энергия,
отвечающая электрону в молекуле, ниже, чем в атоме, МО наз. связывающей, если
выше-разрыхляющей. Если же орбитальная энергия при переходе от атомов к молекуле
почти не изменяется, как в случае неподеленных пар электронов, МО наз. несвязывающей.
Схематически образование
МО из АО часто передают корреляц. диаграммами. Правила построения кор-реляц.
диаграмм состоят в том, что наиб, вклад в МО дают АО с близкими орбитальными
энергиями. Кроме того, эти АО должны относиться к одному типу симметрии относительно
операций симметрии молекулы. Напр., в случае диаграммы, представленной на рис.
2, АО типа 2рх в молекуле оказывается 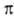 -орбиталью,
а АО типа 2р. -
-орбиталью,
а АО типа 2р. -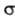 -орби-талью,
т.е. АО 2рх и 2рz не должны одновременно
входить в состав одной и той же МО.
-орби-талью,
т.е. АО 2рх и 2рz не должны одновременно
входить в состав одной и той же МО.
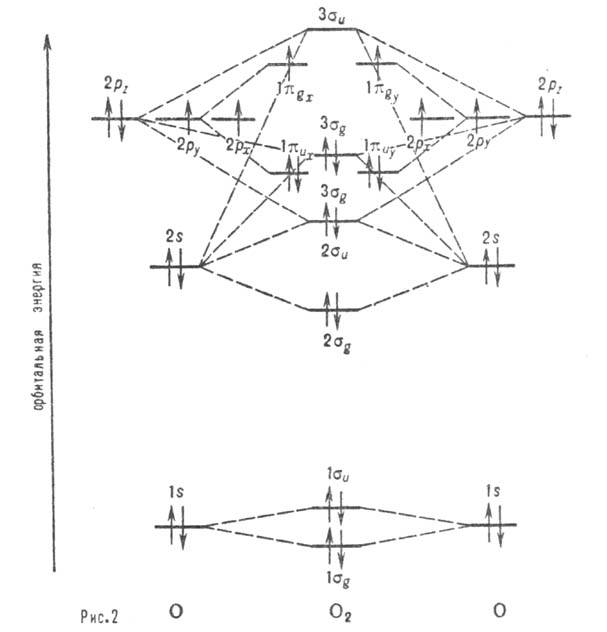
Рис. 2. Корреляц. диаграмма
для молекулы О2. Горизонтальные линии отвечают энергиям атомных и
мол. орбиталей. Пунктирные линии указывают, в какие мол. орбитали входят данная
атомная орбиталь с большим вкладом. Орбитали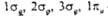 -связывающие, а
-связывающие, а  -разрыхляющие.
Стрелками обозначено заполнение орбиталей в основном (низшем по энергии) состояния
молекулы О2 (триплетное состояние).
-разрыхляющие.
Стрелками обозначено заполнение орбиталей в основном (низшем по энергии) состояния
молекулы О2 (триплетное состояние).
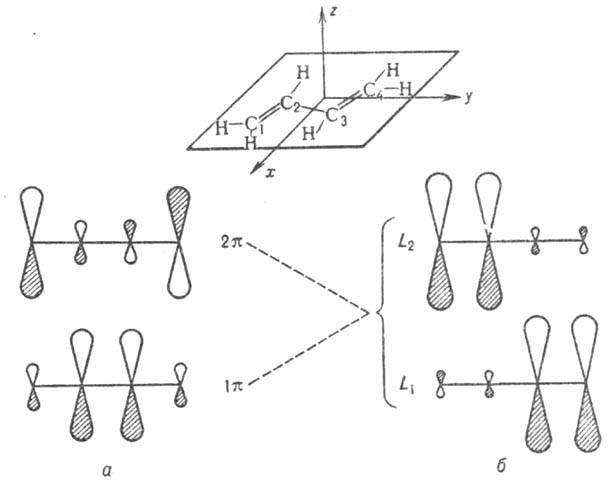
Рис. 3. Занятые p-орбитали
основного состояния 1,3-бутадиена; а- 1 -
и 2
-
и 2 -орбитали;
б-локализованные орбитали p-типа, полученные из 1
-орбитали;
б-локализованные орбитали p-типа, полученные из 1 -
и 2
-
и 2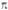 -орбиталей.
Орбитали расположены в порядке возрастания орбитальных энергий.
-орбиталей.
Орбитали расположены в порядке возрастания орбитальных энергий.
Обычно МО изображают графически,
указывая систему АО 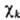 ,
ее образующих (рис. 3). При этом изображают контуры АО, расположенных вблизи
соответствующих ядер молекулы. Размеры АО на рис. отражают величину коэф. перед
ней в представлении МО , а знаки (фазы) АО
учитывают знак Ck. В хим.
,
ее образующих (рис. 3). При этом изображают контуры АО, расположенных вблизи
соответствующих ядер молекулы. Размеры АО на рис. отражают величину коэф. перед
ней в представлении МО , а знаки (фазы) АО
учитывают знак Ck. В хим.  приложениях применяют несимметричные О., локализованные в отдельных областях
пространства и описывающие в этих областях распределение электронной плотности.
Закономерности строения локализованных О. в эквивалентных фрагментах разл. молекул
часто связывают с предоставлением о гибридизации АО.
приложениях применяют несимметричные О., локализованные в отдельных областях
пространства и описывающие в этих областях распределение электронной плотности.
Закономерности строения локализованных О. в эквивалентных фрагментах разл. молекул
часто связывают с предоставлением о гибридизации АО.
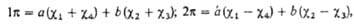
где 0 = 0,372, b
= 0,602, 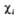 -атомная
орбиталь 2pz атома Сi (i=1, 2, 3,
4). 1
-атомная
орбиталь 2pz атома Сi (i=1, 2, 3,
4). 1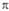 -орбиталь
имеет одну узловую плоскость (ху), 2
-орбиталь
имеет одну узловую плоскость (ху), 2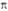 -орбиталь
имеет дополнит. узловую плоскость, перпендикулярную этой плоскости и проходящую
между атомами С2 и С3. Локализованные орбитали отвечают
в осн. хим. связям C1—С2
(L1) и C3-C4 (L2):
L1=
-орбиталь
имеет дополнит. узловую плоскость, перпендикулярную этой плоскости и проходящую
между атомами С2 и С3. Локализованные орбитали отвечают
в осн. хим. связям C1—С2
(L1) и C3-C4 (L2):
L1=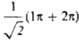 , L2 = . Напр., L1
= с(
, L2 = . Напр., L1
= с( 1
+
1
+ 2)
+ d(
2)
+ d(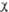 з
-
з
-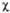 4),
где d = 0,162, с = 0,689. Изолир.
4),
где d = 0,162, с = 0,689. Изолир. 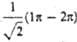 двойной связи С1=C2 отвечает орбиталь я-типа
0,707 ·(
двойной связи С1=C2 отвечает орбиталь я-типа
0,707 ·( 1
+
1
+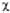 2).
2).
Базисные орбитали. Помимо
рассмотренных АО и МО, имеющих ясный физ. смысл, в квантовой химии часто используют
О., к-рые определяют формальным образом. Таковы, в частности, базисные О., линейная
комбинация к-рых позволяет правильно описать АО или МО в ЛКАО-приближении. В
роли базисных используют О., близкие по форме к атомным О. Напр., слэйтеровские
О. имеют вид 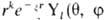 ), гауссовы О.-
), гауссовы О.-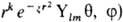 или xaybzc
или xaybzc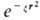 (декартовы гауссовы орбитали). Нередко в роли базисных О. используют линейные
комбинации неск. гауссовых О. (при этом говорят о сгруппированных, или сжатых,
О.).
(декартовы гауссовы орбитали). Нередко в роли базисных О. используют линейные
комбинации неск. гауссовых О. (при этом говорят о сгруппированных, или сжатых,
О.).
В простейших случаях базисные
О. представляют собой АО, полностью или частично занятые в низших электронных
состояниях атома. В этом случае базис О. наз. одноэкспо-нентным минимальным.
Если для описания каждой АО используют две базисные О., базис наз. двухэкспонентным,
и т. п. Чаще всего низшие по энергии остовные АО описываются одной базисной
О., а валентные - несколькими (валентно-расщепленные базисы О.). В неэмпирических методах
квантовой химии используются разл. типы базисов О., за к-рыми формально
сохраняется название АО.
Представление об О. широко
используется в химии для описания образования хим. связи и перераспределения
электронной плотности при изменении строения молекул. Изменения остовных МО
и соответствующих орбитальных энергий используют для интерпретации рентгеноэлектронных
и фотоэлектронных спектров молекул. Высшие занятые и низшие виртуальные (незанятые)
МО наиб. сильно меняются при к.-л. воздействиях на молекулу. Это позволяет использовать
такие граничные МО для предсказания направления хим. р-ции. Напр., электрофильная
атака наиб. вероятна в положение, отвечающее максимуму плотности низшей виртуальной
МО, а нуклеофильная атака-в положение, отвечающее максимуму плотности высшей
занятой МО (см. Граничных орбиталей теория
). Св-ва граничных О. связаны
с индексами реакционной способности
.
Обычно при хим. р-ции сохраняются
нек-рые элементы симметрии взаимодействующих молекул; при этом сохраняется и
тип симметрии МО. Это позволяет судить о том, изменяется или не изменяется электронная
конфигурация многоэлектронной системы при переходе от реагентов к продуктам.
Поскольку изменение электронной конфигурации приводит к появлению заметных потенц.
барьеров на пути р-ции, классификация МО по их симметрии позволяет предсказать
возможность протекания р-ции в заданных условиях активации (см. Вудворда-Хофмана правила
).
Лит. см. при ст.
Квантовая химия
. В. И. Пупышев.
|

