ПАУЛИ ПРИНЦИП
, фундаментальный
принцип квантовой механику согласно к-рому у системы тождественных элементарных
частиц с полуцелым спином (фер-мионов) каждое квантовое состояние м. б. заполнено
не более чем одной частицей. В. Паули сформулировал этот принцип, названный
им принципом запрета, в январе 1925, незадолго до того, как была создана квантовая
механика (1925-26), для объяснения наблюдаемых закономерностей в электронных
спектрах атомов, помещенных в магн. поле. Согласно этой формулировке, в атоме
не может существовать двух или более электронов, для к-рых значения всех четырех
квантовых чисел n, l, mi, и ms
одинаковы (см. Атом
). В то время понятие спина
еще не было
введено, поэтому четвертое квантовое число не описывалось В. Паули никакой моделью.
Он назвал связанное с ним св-во "характерной двузначностью квантовых свойств
электрона, которую нельзя описать классически".
Впоследствии было показано
(П. Дирак, 1926), что П. п. является следствием антисимметричности волновой
ф-ции системы относительно перестановок электронов. В случае системы из N невзаимодействующих электронов антисимметричная волновая ф-ция Y(x1,
x2, ..., xN) м. б. представлена в виде
определителя (детерминанта), составленного из волновых ф-ций электронов ykp
(xi) в квантовых состояниях kp , характеризуемых
каждое четырьмя квантовыми числами (xi - совокупность
пространств. координат и спина i-го электрона):
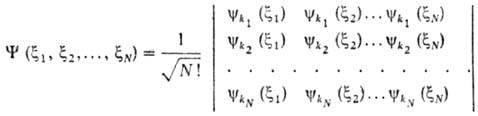
Если к.-л. две строки детерминанта
совпадают, он тождественно обращается в нуль. Отсюда следует, что все наборы
квантовых чисел kp должны быть разными, т. е. не м. б. двух
электронов в одном состоянии.
В дальнейшем принцип запрета
был сформулирован для всех известных частиц, а не только для электронов (В.
Паули, 1940). А именно: в системе тождеств. частиц со спином s осуществляются
только такие состояния, для к-рых полная волновая ф-ция при перестановке любой
пары частиц умножается на (—1)2s, т.е. волновая ф-ция симметрична
для целочисленных s (система частиц подчиняется статистике Бозе-Эйнштейна)
и антисимметрична при полуцелых s (статистика Ферми-Дирака). Частицы
с целыми значениями спина наз. бозонами, с полуцелыми - фер-мионами.
Принцип запрета относится
и к перестановочной симметрии составных частиц, напр, атомных ядер. В зависимости
от спина ядра можно говорить о ядрах-бозонах и ядрах-фермионах. Учет П. п. для
ядер молекулы проявляется, в частности, во вращательных спектрах
. Напр.,
в молекуле 16O2 ядра атомов 16O состоят из
четного числа нуклонов-фсрмионов и потому имеют целочисл. спин (являются бозонами).
Это означает, что волновая ф-ция молекулы 16O2 должна
быть симметричной относительно перестановок ядер. Это приводит к запрету всех
вращат. уровней энергии с нечетными значениями вращат. момента, что подтверждается
наблюдаемыми закономерностями во вращат. спектрах.
Понятие квантового состояния
частицы в системе справедливо в тех случаях, когда взаимод. между частицами
можно заменить нек-рым эффективным полем, а каждую частицу можно характеризовать
индивидуальным набором квантовых чисел; при строгом рассмотрении системы взаимод.
частиц существуют только квантовые состояния всей системы в целом. Одночастичное
приближение лежит в основе метода самосогласов. поля (метод Хартри-Фока; см. Молекулярных орбиталей методы
), широко применяемого в теории атомных
и мол. спектров, квантовой теории хим. связи, при описании оболочечных моделей
атома и ядра и т.д.
П. п. в рамках одночастичного
приближения позволяет обосновать периодич. систему хим. элементов Д. И. Менделеева,
т.к. наличие в одном состоянии только одного электрона объясняет последовательность
заполнения электронных оболочек и связанную с этой последовательностью периодичность
св-в элементов. Макс. число электронов в оболочке с главным квантовым числом
n определяется, согласно П. п., числом разл. наборов квантовых чисел
l, ml, и ms,
т. е. равно 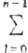 2(2l + 1) = 2n2. Отсюда получаются числа заполнения
электронных оболочек в порядке возрастания номера оболочки: 2, 8, 18, 32 ...
Для эквивалентных электронов атома, т. е. электронов с одинаковыми n и
l, в силу П. п. осуществляются не все возможные состояния, а лишь те,
к-рые различаются ml или ms. B частности,
для электронной конфигурации (пр)2 правило векторного сложения
моментов кол-ва движения дает шесть термов: 1,3S, 1,3P
1,3D, из к-рых разрешены только три: 1S,
3P и 1D, т. к. для остальных трех термов
наборы квантовых чисел для двух электронов совпадают. Учет П. п. необходим также
при нахождении разрешенных электронных состояний молекул и мол. комплексов.
П. п. играет фундам. роль в квантовой теории твердого тела
, теории ядерных реакций
и р-ций между элементарными частицами
.
2(2l + 1) = 2n2. Отсюда получаются числа заполнения
электронных оболочек в порядке возрастания номера оболочки: 2, 8, 18, 32 ...
Для эквивалентных электронов атома, т. е. электронов с одинаковыми n и
l, в силу П. п. осуществляются не все возможные состояния, а лишь те,
к-рые различаются ml или ms. B частности,
для электронной конфигурации (пр)2 правило векторного сложения
моментов кол-ва движения дает шесть термов: 1,3S, 1,3P
1,3D, из к-рых разрешены только три: 1S,
3P и 1D, т. к. для остальных трех термов
наборы квантовых чисел для двух электронов совпадают. Учет П. п. необходим также
при нахождении разрешенных электронных состояний молекул и мол. комплексов.
П. п. играет фундам. роль в квантовой теории твердого тела
, теории ядерных реакций
и р-ций между элементарными частицами
.
Лит.: Ван-Дер-Варден
Б., в сб.: Теоретическая физика 20 в., M., 1962, с. 231; Паули В., там же, с.
357; Каплан И. Г., "Успехи фнз. наук", 1975, т. 117, в. 4, с. 691--704;
его же, в сб.: Теоретико-групповые методы в физике, т. 1, M., 1980, с. 175;
Ландау Л. Д., Лифшиц E. M., Квантовая механика, 4 изд.. M., 1989. И. Г. Каплан.
|

