ПЕПТИДОГЛИКАНЫ
(муреины,
мукопептиды), смешанные углевод-белковые полимеры, компоненты клеточной стенки
бактерий. Углеводные
цепи П. построены из регулярно чередующихся остатков N-ацетил-D-глюкозамина
и его 3-О-(R)-1-кар-боксиэтилового эфира (мурамовой к-ты), соединенных
b-l  4-связями. Мурамовая к-та связана пептидной связью с тетра- или пентапептидами,
к-рые образуют поперечные сшивки между отдельными углеводными цепями (см. схему).
Гигантские сетчатые молекулы П. образуют жесткий чехол вокруг бактериальной
клетки, к-рый поддерживает ее форму и защищает клетку от разрушения при мех.
и осмо-тич. воздействиях. К П. ковалентными связями присоединяются др. компоненты
клеточной стенки - тейхоевые кислоты
и тейхуроновые к-ты, липопротеины
.
4-связями. Мурамовая к-та связана пептидной связью с тетра- или пентапептидами,
к-рые образуют поперечные сшивки между отдельными углеводными цепями (см. схему).
Гигантские сетчатые молекулы П. образуют жесткий чехол вокруг бактериальной
клетки, к-рый поддерживает ее форму и защищает клетку от разрушения при мех.
и осмо-тич. воздействиях. К П. ковалентными связями присоединяются др. компоненты
клеточной стенки - тейхоевые кислоты
и тейхуроновые к-ты, липопротеины
.
Углеводные цепи П., выделенных
из разл. бактерий, отличаются незначительно. Так, аминогруппы остатков мурамовой
к-ты в нек-рых П. могут быть свободны, ацилирова-ны гликолевой к-той или образуют
амидную связь с соседней карбоксильной группой; изредка встречается аналог мурамовой
к-ты, имеющий D-манно-конфигурацию. Аминогруппы остатков глюкозамина
также иногда свободны; отдельные гидроксильные группы полимера м. б. ацетилирова-ны
или фосфорилированы. Напротив, пептидные фрагменты П. характеризуются очень
сильной изменчивостью: известно ок. 100 разл. структур пептидных участков, общими
чертами к-рых является обязательное наличие остатков аминокислот D-ряда и присутствие
редких диаминокислот (L-гидроксилизина, L-орнитина, мезо
-диаминопимелиновой
к-ты и др.). В большинстве П., как показано на схеме, поперечные сшивки построены
по типу А (с дополнит. пептидным мостиком I в грамположит. бактериях), реже
встречаются сшивки типа В.
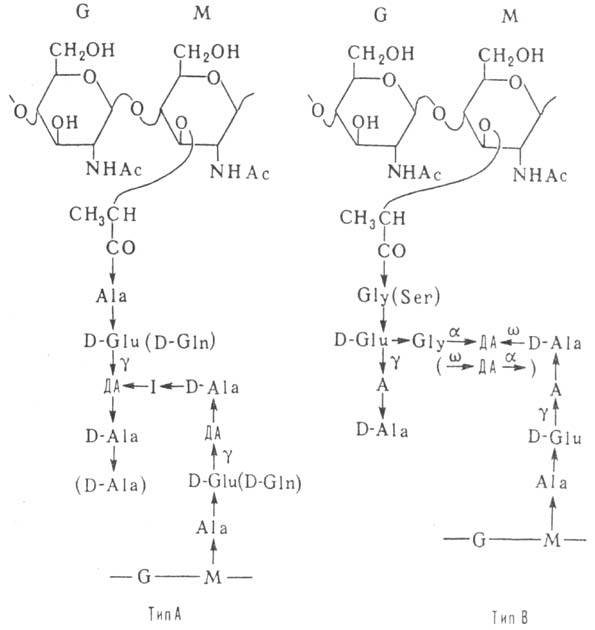
A L-аминокислота, ДА диаминокислота, I межпеш-идный мостик (состоит из неск. остатков аминокислот,
но может отсутствовать), а а-аминогруппа диами-нокислоты, g-g-карбоксил отстатка D-глутаминовой к-ты. w дистальная (отдаленная) аминогруппа остатка диаминокнслоты,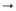 направление пептидной связи СО NH, G остаток N-ацетил-О-глюкозамина. M остаток N-ацетил-D-мурамовой к-ты.
направление пептидной связи СО NH, G остаток N-ацетил-О-глюкозамина. M остаток N-ацетил-D-мурамовой к-ты.
Биосинтез П. начинается
с образования УДФ-N-ацетил-D-мурамовой к-ты (УДФ-уридиндифосфат) из УДФ-N-ацетил-D-глюкозамина
и фосфоенолпирувата, после чего происходит последоват. присоединение аминокислотных
остатков к карбоксильной группе остатка молочной к-ты (напр., L-Ala, D-Glu,
L-Lys и D-Ala—D-Ala во мн. грамположит. бактериях с образованием нуклеотид-мурамил-пентапептида;
букв. обозначения см. в ст. Аминокислоты
). Затем остаток мурамилпептидфосфата
переносится на ундекапренилфосфат; дальнейшие стадии: присоединение остатка
N-ацетил-D-глюкозамина b-l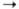 4-связью
к остатку мурамовой к-ты, наращивание пептидной цепи по w-аминогруппе диаминокислоты
(напр., присоединение пяти остатков глицина в грамположит. бактериях с образованием
будущего межпептидного мостика I; см. схему) и присоединение дисахаридпептидного
повторяющегося звена к растущей линейной углеводной цепи - происходят на мембране
под действием мембранных ферментов. Заключит. стадия-образование поперечных
сшивок-происходит на наружной стороне мембраны путем транспептидазной р-ции
(с потерей концевого D-Ala пентапептидного фрагмента).
4-связью
к остатку мурамовой к-ты, наращивание пептидной цепи по w-аминогруппе диаминокислоты
(напр., присоединение пяти остатков глицина в грамположит. бактериях с образованием
будущего межпептидного мостика I; см. схему) и присоединение дисахаридпептидного
повторяющегося звена к растущей линейной углеводной цепи - происходят на мембране
под действием мембранных ферментов. Заключит. стадия-образование поперечных
сшивок-происходит на наружной стороне мембраны путем транспептидазной р-ции
(с потерей концевого D-Ala пентапептидного фрагмента).
Антибиотики, нашедшие широкое
применение в медицине (пенициллины, цефалоспорины, циклосерин и нек-рые др.),
блокируют отдельные стадии биосинтеза П.; отсутствием П. в клетках эукариот
(все организмы, за исключением бактерий и синезеленых водорослей) объясняется
избирательность этих антибиотиков по отношению к бактериальным клеткам. Бактерицидное
действие фермента лизоцима
обусловлено расщеплением углеводных цепей
П. путем гидролиза гликозидных связей остатков N-ацетил-D-мурамовой к-ты.
Наиб. богаты П. клеточные
стенки грамположит бактерий (до 50% по массе), стенки грамотрицат. бактерий
содержат менее 10%
П., а в микоплазмах (клетки, лишенные клеточной стенки) и архебактериях (группа
бактерий, отличающаяся от истинных бактерий, или эубактерий, по ряду физиол.
и биохим. св-в) П. отсутствуют. Сведения о строении П., получаемые с помощью
методов структурного анализа углеводов и пептидов, представляют большую ценность
для таксономии, в первую очередь при идентификации грамположит. бактерий, где
разнообразие структур П. особенно велико.
П. и фрагменты их молекул
обладают разнообразным биол. действием на клетки и на организм животных и человека.
В частности, П. являются носителями неск. антигенных детерминант, способны стимулировать
неспецифич. устойчивость к бактериальным инфекциям, обладают адъювантной активностью
(повышают иммуногенность антигена), могут вызывать воспаление, поражение внутр.
органов, увеличивать проницаемость капилляров, проявлять пи-рогенный эффект
(повышение т-ры тела).
Лит Франклин T .
Сноу Дж , Биохимия антимикробного действия, пер с англ M . 1984. Schleifer K.
H.. "Methods Microbiol.". 1985, v 18, p. 123 56.
А И Усов
|

