ПЕРЕАМИНИРОВАНИЕ
(трансаминирование),
обратимый перенос аминогруппы из молекулы одного орг. соед. в молекулу другого.
Наиб. роль П. играет
в биохимии в процессах метаболизма азотистых оснований в тканях животных и растений.
Заключается в переносе аминогруппы от молекулы a-аминокислоты в молекулу
a-кетокислоты, как правило с участием ферментов - аминотрансфераз (трансаминаз),
напр. по р-ции:
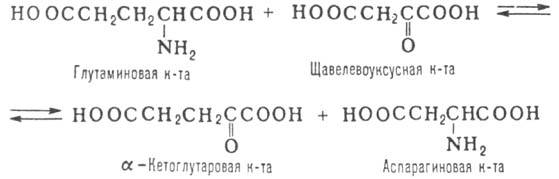
В живых организмах на р-циях
такого типа основываются синтез и диссимиляция аминокислот.
Аминотрансферазы (более
50 разновидностей) содержат в качестве кофсрмента производные витамина В6-пири-доксаль-5-фосфат
(ф-ла I) и пиридоксамин-5-фосфат (II). В основе каталитич. активности пиридоксаль-5-фосфата
лежит способность его формильной группы образовывать с аминокислотами шиффовы
основания, легко гидролизующиеся до пиридоксамин-5-фосфата и a-кетокислоты.
Общая схема П. с участием этих ферментов представляет собой сумму двух полуреакций:
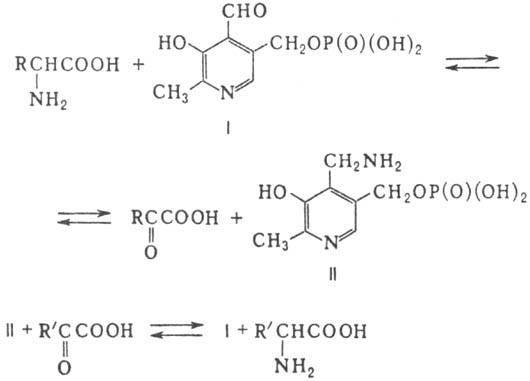
A. E. Браунштейн и M. M.
Шемякин в 1953 сформулировали общий механизм П. в биол. системах, состоящий
из ряда промежут. стадий. Подробно механизм П. под действием аминотрансфераз
рассмотрен в ст. Аспартатаминотранс· фераза.
Нарушение нормального течения
П. в организме наблюдается при патологич. состояниях, напр. при инфаркте миокарда,
заболеваниях печени. Контроль концентрации аминотрансфераз используется в этих
случаях как ср-во диагностики. П. в организме подавляется противотуберкулезными
лек. ср-вами (изониазидом, циклосерином и др.), а также при В6-авитаминозе.
П. аминокислот может происходить
и вне клетки в присут. пиридоксаль-5-фосфата, однако скорость р-ции в 106
раз меньше. Специфичность действия определяется пространств, структурой субстрата,
положением ионогенных групп белка, осуществляющих кислотно-основной катализ,
и геометрией связывания субстрата.
В орг. химии примером П.
может служить обмен одной аминогруппы в молекуле на другую при р-ции с аминами:
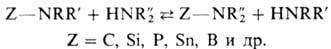
Сдвиг равновесия определяется
разностью основностей исходных аминов и продуктов р-ции, а также соотношением
концентраций реагентов. Проводят р-ции при повыш. т-ре в присут. катализаторов
(к-ты, основания, нек-рые металлы или их оксиды) или без них; протекает обычно
по механизму SN2. Каталитическое П. в зависимости от агрегатного
состояния катализатора осуществляют в жидкой фазе под давлением или в газовой
фазе.
К П. относят также превращ.
a-кетокислоты в a-амино-кислоту при нагр. с др. аминокислотой в водном
р-ре (р-ция Хербста - Энгеля):
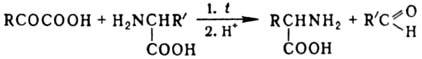
Лит.: Геллер Б.
А., "Успехи химии", 1978, т. 47, в. 3, с. 537-56; Мецлер Д., Биохимия,
пер. с англ., т. 2, M., 1980, с. 209-32; Браун-штейн A. E., Процессы и ферменты
клеточного метаболизма. Сб. статей, M., 1987; Марч Дж., Органическая химия,
пер. с англ., т. 2, M., 1988, с. 150.
M. В. Шиманская.
|

