 |
Реклама |
|
|
 |
Примеры П.с.-ионные пероксиды
и гидропероксиды Na2O2, BaO2, NH4OOH;
координац. пероксиды и гидропероксиды [Nb(O2)] 3—, [Ti(O2)F5]
3—, [BF3OOH]—; пероксокислоты и их соли H2CO4,
KHSO5; пероксосольваты Na2CO3·1,5H2O2,
СО(NH2)2·H2O2; соли пероксония H3O2+AsF6—,
H3O2+SbF6— ; ионные супероксиды
NaO2, KO2, Са(О2)2; координац. супероксиды
[Co(O2)(CN)5]3—, [{Co(NH3)5}2(O2)]5+
; озониды KO3, RbO3, CsO3; комплексы с мол.
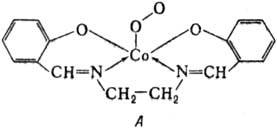
кислородом-соед. ф-лы А ("салькомин"); соли диоксигенила
O2BF4, O2PtF6. Пероксиды. Пероксиды щелочных
металлов М2О2-бесцв. кристаллы, решетка к-рых построена
из ионов O22— и M+ (табл. 2). В водном р-ре
полностью гидролизуют-ся до MOH и H2O2, в случае П. с.
Li и Na гидролиз в значит. степени обратим; из водно-пероксидного р-ра кристаллизуются
пероксосольваты, напр. Li2O2·2H2O2,
Na2O2·2H2O2·4H2O. Известны также K2O2·nH2O2
(n= 2,4). Состав сольватов определяется т-рой и концентрацией H2O2
и щелочи в р-ре. M2O2 реагируют с парами воды и
с CO2, выделяя O2 и образуя MOH и M2CO,- Активность
M2O2 в этой р-ции растет от Li2O2
к Cs2O2. На этой р-ции основано применение Li2O2
и Na2O2 в качестве компонентов регенеративных в-в в дыхат.
аппаратах изолирующего типа. M2O2-довольно активные окислители,
мн. орг. в-ва (спирты, эфиры и др.) воспламеняются в контакте с ними. Taбл. 2.-СВОЙСТВА ПЕРОКСИДОВ
МЕТАЛЛОВ
Пром. способом производят
только натрия пероксид
и немного Li2O2(Hs LiOH
и H2O2 в воде с послед. сушкой сольвата). Пероксиды элементов II
группы MO2 образуют все щел.-зем. металлы. Бесцв. кристаллы, малогигроскопичны.
Т-ра распада MO2 растет от Mg к Ba, причем в случае соед. Ba и Sr
р-ция MO2 Пероксиды щел.-зем. металлов
как твердые окислители и оксигенирующие агенты химически менее активны, чем
пероксиды щелочных металлов, их реакц. способность проявляется при повыш. т-рах.
В отсутствие влаги BaO2 реагирует с N2O с образованием
Ba (NO2) 2 и N2 при 500-600 0C,
с NO2, давая Ba(NO3)2, при 120-140 0C,
с NH3 выше 500 0C. В присут. паров воды эти р-ции, а также
поглощение CO2 идут при более низкой т-ре. BaO2 окисляет
оксиды металлов при 230-430 0C с образованием солей Ba или смешанных
оксидов; напр., с Cr2O3 дает BaCrO4, с MnO5
Mn3O4 и MnO2-BaMnO4. Пероксиды щел.-зем. металлов
устойчивы к действию воды, их гидролиз протекает медленно; из р-ров H2O2
в воде или M (OH)2 и H2O2 в воде они кристаллизуются
в виде кристаллогидратов и пероксосольватов состава MO2· 8H2O,
MO2·2H2O2 и MO2·H2O2.
Октагидраты довольно устойчивы, теряют воду ок. 400 0C без разложения.
Пероксосольваты менее устойчивы, их термич. распад в вакууме протекает по двум
параллельным направлениям-отщепление и разложение кристаллизационной H2O2
и диспропорциони-рование по схеме 2(MO2·2H2O2) Макс. содержание M(О2)2
в смеси в случае Ba ~ 10%, в случае Sr ~ 30%, Ca до 60%, Mg ок. 1%. Пероксиды щел.-зем. металлов
получают р-цией их гид-роксидов с водной H2O2 или взаимод.
р-ра H2O2 с р-рами солей в присут. NH3 с послед.
сушкой выпавшего сольвата. При получении MgO2 из Mg(OH)2
концентрация р-ра H2O2 более 30%, после сушки препараты
содержат не менее 0,5 моля H2O на моль MgO2. BaO2
получают также р-цией BaO с O2 воздуха при 330-530 0C.
BaO2, CaO2 и небольшие кол-ва MgO2 производят
в пром. масштабе. BaO2 (см. также Бария оксид) - компонент
трассирующих составов, капсюлей-детонаторов и запалов замедленного действия,
BB, термитных смесей, твердых источников O2, катализаторов полимеризации
олефинов. CaO2 применяют для очистки сточных вод, для отбеливания
бумаги и пряжи, в хлебопечении для улучшения пластич. св-в теста, в качестве
добавки к удобрениям для рисовых плантаций, в составе регенеративных в-в, для
вулканизации полисульфидных каучуков и др.
MgO2 входит в состав антисептич. ср-в и отбеливающих композиций.
Все пероксиды служат, кроме того, эффективными бактерицидными, спороцидными
и деконтаминирую-щими ср-вами. Пероксиды Zn и Cd имеют
кремовую окраску, вызванную, по-видимому, примесью супероксидов. Получают их
действием H2O2 на оксид, гидроксид или водно-аммиачный
р-р соли Zn или Cd, ZnO2-также р-цией Zn(NO3)2
с NaO2 в жидком аммиаке. ZnO2-компонент мазей для лечения
ран и ожогов, для предотвращения газовой гангрены; используется при вулканизации
и полимеризации. Пероксид HgO2 известен в двух модификациях - желтой
a, взрывающей при нагр. и ударе, и более стабильной красно-оранжевой b. Гидропероксиды Супероксиды. Супероксиды
щелочных металлов MO2-кристаллы (табл. 3), окрашены в разл. оттенки
желтого цвета; термохроны - с ростом т-ры интенсивность окраски усиливается,
а ниже 100 К окраска почти исчезает; полиморфны. NaO2 и KO2
немного раств. в жидком NH3, а в присут. краун-эфиров KO2
хорошо раств. в ДМСО и др. Табл. 3. СВОЙСТВА СУПЕРОКСИДОВ
ЩЕЛОЧНЫХ МЕТАЛЛОВ
неводных средах. LiO2
термически неустойчив, в индивидуальном виде не выделен; образуется при действии
O3 на суспензию Li2O2 в хладоне 12 ниже 170
К или в аргоновой матрице при совместной конденсации паров Li и O2
при 14 К. Остальные MO2 при комнатной т-ре в отсутствие влаги и CO2
вполне стабильны. Термич. распад MO2 идет через промежут. образование
M2O2 и твердых р-ров MO2 в M2O2,
стадия 2MO2 Супероксиды щел.-зем. металлов
М(О2)2 образуются в смеси с M(OH)2 и MO2
при вакуумно-термич. обработке MO2·2H2O2, где
M = Ca, Sr, Ba. Термич. устойчивость M(O2)2 тем ниже,
чем выше содержание его в смеси. Для Ca(O2)2 рассчитаны
В пром-сти KO2
получают р-цией К с O2 ок. 327 0C (расплавл. К с помощью
форсунки впрыскивают в воздух, обогащенный O2). Аналогично можно
синтезировать RbO2 и CsO2, но не NaO2, к-рый
получают медленным нагреванием Na2O2 до 230-430 0C
в автоклаве при давлении O2 10-15 МПа. Продукт содержит 85-95%
NaO2; более чистый NaO2 м. б. получен действием O2
на Na в среде 1, 2-димет-оксиэтана в присут. флуорена или бензофенона при нормальных
условиях. NaO2 и KO2 - компоненты регенеративных в-в,
используемых для поддержания постоянного состава атмосферы в замкнутых обитаемых
помещениях. Пероксокислоты. Неустойчивы
и в своб. состоянии, и в водном р-ре, но соли нек-рых из пероксокислот стабильны.
Пероксобораты -
наиб. многочисл. группа солей пероксокислот. Известны
два пероксокарбонатных аниона - пероксо-монокарбонат Пероксосольваты (пероксогидраты,
пергидраты, гидропе-роксидаты) - продукты присоединения (в результате образования
водородных связей) H2O2 к анионам неорг. или орг. K-T
и нек-рым нейтральным молекулам. Кристаллы; могут служить твердыми носителями
H2O2. Наиб. известны натрия пероксокарбонат
Na2CO3·1,5H2O2
и соед. H2O2 с мочевиной CO(NH2)•H2O2
(гидроперит). Большинство пероксо-сольватов термически неустойчивы, отщепление
и распад присоединенной H2O2 происходит при 82-147 0C.
При растворении в воде пероксосольваты распадаются на исходные компоненты. Связь
H2O2 с анионом к-ты тем прочнее, чем выше отрицат. заряд
и меньше число атомов аниона. Известны пероксосольваты фторидов, напр. KF·n
H2O2, где n = 1, 2, 3, оксалатов M2C2O4·H2O2,
сульфатов, напр. (NH4)2SO4·H2O2,
и др. Получают пероксосольваты кристаллизацией из водных р-ров, содержащих H2O2
и соответствующую соль. Пероксокарбонат Na и гидроперит производят в пром-сти;
их р-ры применяют для отбеливания, дезинфекции и в др. областях, где используют
H2O2. В очень кислых средах молекула
H2O2 присоединяет H и образует пероксониевый катион [HOOH2]+,
соли к-рого H3O2+ AsF6—
, H3O2+ Sb2F11—,
H3O2+ SbF6— выделены
из р-ра в безводном HF; все они распадаются при 22-47 0C на O2
и соли H3O+. Координационные пероксиды
и супероксиды. Наиб. характерны соед. с Пероксокомплексы типа I
особенно характерны для Cr, Ti, V, Mo, Nb, Zr, Та, W, Hf, U. Пероксо- и супероксоком-плексы
типа II преобладают у Со, Cu, Rh, Ru, Cr, Fe, напр. [{Co(CN)5}2(O2)]5-
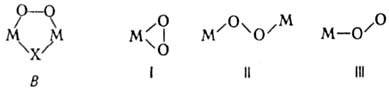
В нек-рых комплексах Cu, Rh, Pt группировка типа II входит в цикл (ф-ла В).
Тип III характерен для супероксокомплексов Со, Cr, Ru, Rh, Mn и мн. комплексов
Fe, Со, Cu и др. с мол. O2. Суперкомплекс [{Al(CH3)3}2(O2)]-
относится к типу III, ковалентные II. с. к типу II. Пероксокомплексы получают
взаимод. солей или комплексов соответствующего металла с H2O2,
супероксокомплексы-из M+ Лит.: Вольнов И.
И.. Перекисные соединения щелочных металлов. M.. 1980; его же, Перекисные соединения
щелочноземельных металлов, M., 1983. В. Я. Росоловский. |

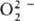 ; супероксиды (гипероксиды) с ионом
; супероксиды (гипероксиды) с ионом 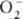 ;
; 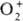 . К ионным П. с. относят также
. К ионным П. с. относят также 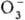 ,
, 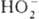 ,
, 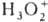 .
Среди ионных П. с. только пероксиды диамагнитны и не окрашены (или их окраска
не связана с пероксид-ной группой), остальные парамагнитны и, как правило, ярко
окрашены.
.
Среди ионных П. с. только пероксиды диамагнитны и не окрашены (или их окраска
не связана с пероксид-ной группой), остальные парамагнитны и, как правило, ярко
окрашены.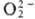 и
и 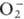 могут
образовывать координац. связи с ионами переходных и непереходных элементов,
соответствующие соед. входят в группу комплексных П. с., близких по св-вам к
ковалентным П. с. Диоксидифторид О2F2, соед. с цепочкой
из трех атомов О (напр., CF3OOOCF3) и нек-рые другие также
можно отнести к П. с. К комплексным П. с. следует отнести соед., обратимо отдающие
кислород,-комплексы с мол. кислородом, важнейший из к-рых-оксигемоглобин. Энергия,
длина и порядок связи О—О в молекуде П.с, зависят от заряда на группе O2
(табл. 1).
могут
образовывать координац. связи с ионами переходных и непереходных элементов,
соответствующие соед. входят в группу комплексных П. с., близких по св-вам к
ковалентным П. с. Диоксидифторид О2F2, соед. с цепочкой
из трех атомов О (напр., CF3OOOCF3) и нек-рые другие также
можно отнести к П. с. К комплексным П. с. следует отнести соед., обратимо отдающие
кислород,-комплексы с мол. кислородом, важнейший из к-рых-оксигемоглобин. Энергия,
длина и порядок связи О—О в молекуде П.с, зависят от заряда на группе O2
(табл. 1).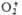
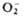
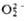
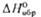
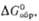
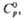
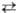 МО
+ l/2O2 обратима; давление диссоциации p
МО
+ l/2O2 обратима; давление диссоциации p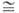 0,1
МПа для BaO2 при 843 0C, для SrO2 при 365 0C.
MgO2 и CaO2 необратимо разлагаются при 330-430 0C.
0,1
МПа для BaO2 при 843 0C, для SrO2 при 365 0C.
MgO2 и CaO2 необратимо разлагаются при 330-430 0C.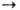 M(О2)2+M(OH)2+3H2O+1,5O2.
M(О2)2+M(OH)2+3H2O+1,5O2.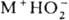 -кислые соли H2O2; малостабильны; присутствуют в щелочных
водных р-рах H2O2. В кристаллич. состоянии надежно установлено
существование только
-кислые соли H2O2; малостабильны; присутствуют в щелочных
водных р-рах H2O2. В кристаллич. состоянии надежно установлено
существование только 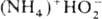 (т. пл. 22-23 0C, при 45 0C полностью разлагается на NH3,
H2O и O2). Вопрос о принадлежности др. соединений эмпирич.
ф-лы MOOH, где M-щелочной металл или (Alk)4N+, к гидропероксидам
или пероксосольватам M2O2·H2O2 не
решен.
(т. пл. 22-23 0C, при 45 0C полностью разлагается на NH3,
H2O и O2). Вопрос о принадлежности др. соединений эмпирич.
ф-лы MOOH, где M-щелочной металл или (Alk)4N+, к гидропероксидам
или пероксосольватам M2O2·H2O2 не
решен.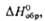
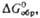
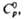
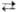 M2O2
+ O2 обратима. При 157 0C время полураспада 6 сут, при
252 0C - ок. 1 ч, добавки V2O5 заметно ускоряют
распад. Скорость термич. распада NaO2 зависит также от дефектности
кристаллов. KO2, RbO2 и CsO2 более устойчивы,
разлагаются при 390-600 0C. Т-ры плавления супероксидов MO2
можно определить только под давлением O2; только для KO2
относительно надежно измерена т. пл. 511 0C. Р-ция MO2
с избытком воды идет по схеме: 2MO2 + 2H2O
M2O2
+ O2 обратима. При 157 0C время полураспада 6 сут, при
252 0C - ок. 1 ч, добавки V2O5 заметно ускоряют
распад. Скорость термич. распада NaO2 зависит также от дефектности
кристаллов. KO2, RbO2 и CsO2 более устойчивы,
разлагаются при 390-600 0C. Т-ры плавления супероксидов MO2
можно определить только под давлением O2; только для KO2
относительно надежно измерена т. пл. 511 0C. Р-ция MO2
с избытком воды идет по схеме: 2MO2 + 2H2O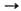 2MOH
+ H2O2 + O2, в присут. катализатора, напр.
MnO2, и при повыш. т-ре-по схеме: 2MO2 + H2O
2MOH
+ H2O2 + O2, в присут. катализатора, напр.
MnO2, и при повыш. т-ре-по схеме: 2MO2 + H2O
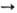 2MOH +
3/2O2 с выделением 305 л O2 на 1
кг NaO2 и 236 л O2 на 1 кг KO2. Супероксиды
Na и К реагируют с влажным CO2 при ~ 20 0C с выделением
всего активного O2 и образованием карбонатов, однако в отсутствие
паров воды р-ция с CO2 начинается лишь при ~ 100 0C. NaO2
и KO2 с СО при 100-180 0C образуют карбонаты, с SO2
в присут. небольшого кол-ва паров воды-M2SO4, при ~20
°С с NO2-MNO3; раств. в расплавах фторидов и нитратов
щелочных металлов, напр. т. пл. эвтектич. сплава KO2 (34 мол. %)
с KNO3 222 0C. Под действием O3 или атомарного
О супероксиды MO2 превращ. в озониды MO3. Выделены супероксиды
тетраалкиламмония, напр.: [(CH3)4N]O2 и [(C2H3]4N]O2-кристаллы;
устойчивы ниже 60
0C, при нагр. взрывают; хорошо раств. в жидком NH3 и орг.
р-рителях.
2MOH +
3/2O2 с выделением 305 л O2 на 1
кг NaO2 и 236 л O2 на 1 кг KO2. Супероксиды
Na и К реагируют с влажным CO2 при ~ 20 0C с выделением
всего активного O2 и образованием карбонатов, однако в отсутствие
паров воды р-ция с CO2 начинается лишь при ~ 100 0C. NaO2
и KO2 с СО при 100-180 0C образуют карбонаты, с SO2
в присут. небольшого кол-ва паров воды-M2SO4, при ~20
°С с NO2-MNO3; раств. в расплавах фторидов и нитратов
щелочных металлов, напр. т. пл. эвтектич. сплава KO2 (34 мол. %)
с KNO3 222 0C. Под действием O3 или атомарного
О супероксиды MO2 превращ. в озониды MO3. Выделены супероксиды
тетраалкиламмония, напр.: [(CH3)4N]O2 и [(C2H3]4N]O2-кристаллы;
устойчивы ниже 60
0C, при нагр. взрывают; хорошо раств. в жидком NH3 и орг.
р-рителях.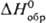 и
и 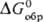 соотв.
— 395 и — 322 кДж/моль. По окраске и хим. св-вам супероксиды щел.-зем. и щелочных
металлов похожи, но первые менее активны.
соотв.
— 395 и — 322 кДж/моль. По окраске и хим. св-вам супероксиды щел.-зем. и щелочных
металлов похожи, но первые менее активны.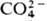 и пероксидикарбонат
и пероксидикарбонат 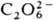 .
Их щелочные соли устойчивы в обычных условиях, но распадаются при небольшом
нагревании; так, KHCO4 при 60-80 0C экзотермически распадается
на K2CO3, CO2, O2 и H2O,
K2C2O6 разлагается при 140-160 0C
эндотермически на K2CO3, CO2 и O2.
Пероксоазотная к-та HNO4 (HOONO2) малоустойчива даже в
разб. р-ре; ее образование в разреженном газе по р-ции HO2 + NO2
.
Их щелочные соли устойчивы в обычных условиях, но распадаются при небольшом
нагревании; так, KHCO4 при 60-80 0C экзотермически распадается
на K2CO3, CO2, O2 и H2O,
K2C2O6 разлагается при 140-160 0C
эндотермически на K2CO3, CO2 и O2.
Пероксоазотная к-та HNO4 (HOONO2) малоустойчива даже в
разб. р-ре; ее образование в разреженном газе по р-ции HO2 + NO2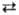 HOONO2
играет важную роль в каталитич. стратосферных циклах, включающих оксиды азота
и радикалы НО• и НО•2 . Соли HNO4
неизвестны, но ее ковалентные производные ROONO2, где R = CH3CO,
CCl3, CF3, вполне стабильны. Соли монопероксофосфорной
к-ты H3PO5 не выделены, а пероксополифосфаты известны,
напр. Na4P2O8 и K4P2O8.
Сера образует две пероксокисло-ты -монопероксосерную H2SO5
(к-та Каро) и более стабильную пероксодисерную H2S2O8,
выделенную в своб. состоянии в виде бесцв. кристаллов с т. пл. 65 0C.
Пероксокислоты и их соли получают анодным окислением соответствующих простых
к-т и солей или р-цией их с H2O2. Пероксосерные к-ты -
промежут. продукты при электрохим. получении H2O2 из р-ров
H2SO4. Пероксокислоты галогенов неизвестны.
HOONO2
играет важную роль в каталитич. стратосферных циклах, включающих оксиды азота
и радикалы НО• и НО•2 . Соли HNO4
неизвестны, но ее ковалентные производные ROONO2, где R = CH3CO,
CCl3, CF3, вполне стабильны. Соли монопероксофосфорной
к-ты H3PO5 не выделены, а пероксополифосфаты известны,
напр. Na4P2O8 и K4P2O8.
Сера образует две пероксокисло-ты -монопероксосерную H2SO5
(к-та Каро) и более стабильную пероксодисерную H2S2O8,
выделенную в своб. состоянии в виде бесцв. кристаллов с т. пл. 65 0C.
Пероксокислоты и их соли получают анодным окислением соответствующих простых
к-т и солей или р-цией их с H2O2. Пероксосерные к-ты -
промежут. продукты при электрохим. получении H2O2 из р-ров
H2SO4. Пероксокислоты галогенов неизвестны.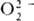 . Один ион металла м. б. координирован с 1-3 и даже 4 ионами
. Один ион металла м. б. координирован с 1-3 и даже 4 ионами 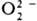 , в последнем случае вся коорди-нац. сфера комплекса занята пероксолигандами,
напр.
, в последнем случае вся коорди-нац. сфера комплекса занята пероксолигандами,
напр. 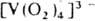
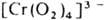 .
Пероксокомплексы со смешанными лигандами [MLх(O2)y
]n+, где L-неорг. анион или молекула или орг. донорныи лиганд.
Структура металл-ди-кислородных фрагментов в большинстве случаев относится к
одному из трех видов: тип I-только для
.
Пероксокомплексы со смешанными лигандами [MLх(O2)y
]n+, где L-неорг. анион или молекула или орг. донорныи лиганд.
Структура металл-ди-кислородных фрагментов в большинстве случаев относится к
одному из трех видов: тип I-только для 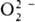 , II -для
, II -для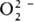 и
и 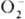 , III
для
, III
для 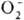 и
и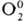
 или прямой р-цией O2 с металлокомплексами. Комплексы с мол. O2
используют для переноса и концентри-рования O2 и для изменения его
реакц. способности ("активация лиганда"). Пероксокомплексы Mo и
V применяют для -)поксидирования олефинов, напр. в пром-сти-для получения пропиленоксида.
или прямой р-цией O2 с металлокомплексами. Комплексы с мол. O2
используют для переноса и концентри-рования O2 и для изменения его
реакц. способности ("активация лиганда"). Пероксокомплексы Mo и
V применяют для -)поксидирования олефинов, напр. в пром-сти-для получения пропиленоксида.