ПИРРОЛ
, мол. м.
67,09; бесцв. жидкость с запахом хлороформа, медленно темнеет при стоянии на
воздухе; т. кип. 130°С,т.пл. -23,40C; 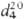 0,9698;
0,9698; 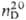 1,5086; m 5,17·10-30Кл·м (чистое в-во), 6,00 · 10-30
Кл · м (р-р в бензоле, циклогексане);
1,5086; m 5,17·10-30Кл·м (чистое в-во), 6,00 · 10-30
Кл · м (р-р в бензоле, циклогексане); 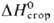 —2364,2 кДж/моль. Гигроскопичен, смешивается во всех отношениях с большинством
орг. r-рителей, плохо раств. в воде (6 г в 100 г воды при 250C).
Молекула П. плоская, полярная, направление диполя-от атома N внутрь кольца.
П.-гетероароматич. соед.; ароматич. система образована 2 парами электронов от
двойных связей и неподеленной парой электронов атома N (p-избыточный гетероцикл).
П.-NH-кислота (рКа 17,5, вода). При
обработке Na или К или их амидами в жидком NH3, а также р-цией с
металлом в инертном р-рителе получают Na- и К-соли П., к-рые алкилируются и
ацилируются по атому N. Литиевую соль получают взаимодействием П. с Li в жидком
NH3 или с бутил- или фениллитием в эфирном р-ре. N-Замещенные П.
металлируются бутил- или фениллитием в положение 2. С реактивами Гриньяра в
эфире П. легко образует N-пирролмагниевые производные, к-рые алкилируются и
ацилируются по атому С-2. Для П. характерны р-ции электроф. замещения, к-рые
преим. идут по a-углеродным атомам. Протонирование П. минер. к-тами приводит
к нарушению ароматичности системы и вызывает полимеризацию (образуется т. наз.
пиррол-красный). Нитрование П. ацетилнитратом приводит к 2-нитропирролу с примесью
3-нитропроизводного; сульфирование комплексом пиридин-SO3 при 1000C-
к образованию пиррол-2-сульфо-кислоты. При р-ции П. с галогенами очень легко
образуется тетрагалогенпиррол. Активные алкилгалогениды (аллил- и бензилгалогениды)
в присут. слабых оснований алкилируют П. в положения 2 и 5, CH3I
при 100-1500C-также и в положения 3 и 4. Ацилирование П. уксусным
ангидридом при 1000C приводит к смеси 2-ацетил- и 2,5-диацетилпирролов.
Наличие в положении 1 электроноакцепторной фенилсуль-фонильной группы изменяет
ориентацию электроф. замещения: ацилирование 1-фенилсульфонилпиррола по Фриде-лю-Крафтсу
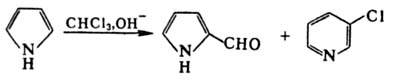
селективно идет по положению 3. Под действием HCN, HCl и POCl3 в
ДМФА или CHCl3 в щелочной среде П. форматируется с образованием 2-формил-пиррола.
При использовании CHCl3 из-за образования дихлоркарбена идет побочная
р-ция с образованием 3-хлорпиридина:
—2364,2 кДж/моль. Гигроскопичен, смешивается во всех отношениях с большинством
орг. r-рителей, плохо раств. в воде (6 г в 100 г воды при 250C).
Молекула П. плоская, полярная, направление диполя-от атома N внутрь кольца.
П.-гетероароматич. соед.; ароматич. система образована 2 парами электронов от
двойных связей и неподеленной парой электронов атома N (p-избыточный гетероцикл).
П.-NH-кислота (рКа 17,5, вода). При
обработке Na или К или их амидами в жидком NH3, а также р-цией с
металлом в инертном р-рителе получают Na- и К-соли П., к-рые алкилируются и
ацилируются по атому N. Литиевую соль получают взаимодействием П. с Li в жидком
NH3 или с бутил- или фениллитием в эфирном р-ре. N-Замещенные П.
металлируются бутил- или фениллитием в положение 2. С реактивами Гриньяра в
эфире П. легко образует N-пирролмагниевые производные, к-рые алкилируются и
ацилируются по атому С-2. Для П. характерны р-ции электроф. замещения, к-рые
преим. идут по a-углеродным атомам. Протонирование П. минер. к-тами приводит
к нарушению ароматичности системы и вызывает полимеризацию (образуется т. наз.
пиррол-красный). Нитрование П. ацетилнитратом приводит к 2-нитропирролу с примесью
3-нитропроизводного; сульфирование комплексом пиридин-SO3 при 1000C-
к образованию пиррол-2-сульфо-кислоты. При р-ции П. с галогенами очень легко
образуется тетрагалогенпиррол. Активные алкилгалогениды (аллил- и бензилгалогениды)
в присут. слабых оснований алкилируют П. в положения 2 и 5, CH3I
при 100-1500C-также и в положения 3 и 4. Ацилирование П. уксусным
ангидридом при 1000C приводит к смеси 2-ацетил- и 2,5-диацетилпирролов.
Наличие в положении 1 электроноакцепторной фенилсуль-фонильной группы изменяет
ориентацию электроф. замещения: ацилирование 1-фенилсульфонилпиррола по Фриде-лю-Крафтсу
селективно идет по положению 3. Под действием HCN, HCl и POCl3 в
ДМФА или CHCl3 в щелочной среде П. форматируется с образованием 2-формил-пиррола.
При использовании CHCl3 из-за образования дихлоркарбена идет побочная
р-ция с образованием 3-хлорпиридина:
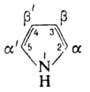
По р-ции Манниха П. превращ.
в 2-диалкиламинометил-пирролы. С активир. алкенами (эфиры акриловой к-ты, акрилонитрил,
малеиновый ангидрид и др.) в присут. к-т или оснований П. вступает в р-цию,
подобную р-ции Михаэля, с образованием продуктов алкилирования в положения 2
и 5. При нагр. с водным р-ром (NH4)2CO3 под
давлением П. карбоксилируется до аммониевой соли пиррол-2-карбоно-вой к-ты.
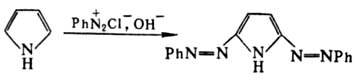
В нейтральной или слабокислой среде вступает в р-цию азосочетания с образованием
2-азопроизводного, в щелочных средах дает бис-азопроизводное, напр.:
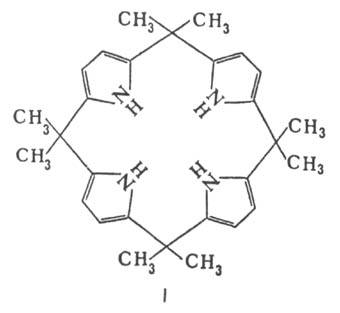
С ацетоном в кислой среде
П. образует циклич. тетрамер ф-лы I.
При умеренных т-ре и давлении
П. легко гидрируется в пирролидин (кат.-Pt, Pd, Ni-Ренея). При восстановлении
с помощью Zn и HCl м. б. выделен 3-пирролин. Воздухом на свету П. окисляется
в имид янтарной к-ты, хромовой к-той-в малеинимид.
В солянокислом р-ре n-диметиламинобензальдегида
(реактив Эрлиха) П. дает красную окраску, с SeO2 в водном р-ре -
фиолетовую, с изатином образует синий осадок. Идентифицируют П. обычно в виде
комплекса с HgCl2 (т.пл. 1430C).
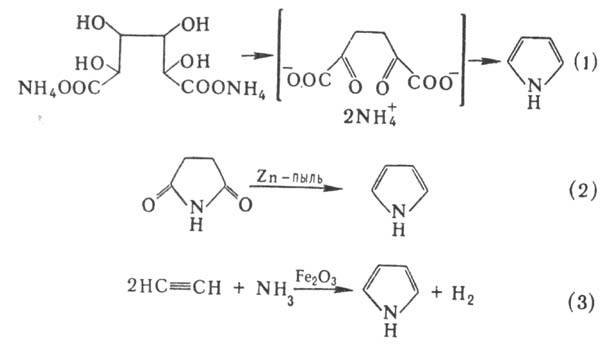
Получают П. перегонкой
аммониевой соли слизевой к-ты (вариант синтеза Пааля-Кнорра, р-ция 1), перегонкой
ими-да янтарной к-ты с цинковой пылью (2), пропусканием ацетилена и NH3
через прокаленную трубку в присут. оксидов Fe (III) или Pb (3), каталитич. аммонолизом
фурана или тиофена в присут. Al2O3 (р-ция Юрьева):
П. содержится в кам.-уг.
смоле. Цикл П.-структурный фрагмент прир. пигментов (напр., тема, хлорофиллов,
желчи, витамина B12, нек-рых антибиотиков), а также нек-рых светостойких
фталоцианиновых красителей.
П. умеренно токсичен; его
пары вызывают стойкое и упорное повышение т-ры тела; ЛД50 74 мг/кг
(кролики, перорально).
П. используют для синтеза
пирролидина и нек-рых лек. ср-в. Он впервые был открыт F. F. Рунге
в 1834 в кам.-уг. смоле; в чистом виде получен T. Андерсоном в 1858 при сухой
перегонке рогов и копыт.
Лит.: Общая органическая
химия, пер. с англ., т. 8, M., 1985, с. 332-88; Gossauer A., Die Chemie der
Pyrrole, В., 1974; J ones R. А., Be a n G. P., The chemistry of pyrroles,
N. Y.-L., 1977; Anderson H. J., Loader C. E., "Synthesis", 1985,
N 4, p. 353-64. M. А. Юровская.
|

