ПИРУВАТКАРБОКСИЛАЗА
,
фермент класса лигаз, катализирующий обратимую р-цию образования щавеле-воуксусной
к-ты (оксалоацетата) из пировиноградной (пирувата):
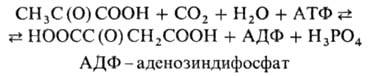
Равновесие р-ции сдвинуто
вправо. Кофермент П.-биотин, связанный с e-аминогруппой остатка лизина,
к-рый расположен в активном центре фермента. АТФ участвует в р-ции в виде Mg-соли.
П. обнаружена только у
животных. Фермент из печени цыпленка состоит из 4 тетрамеров, содержащих по
4 идентичные субъединицы с мол. м. ок. 40 тыс. (мол. м. всей молекулы ок. 660
тыс.). Каждый тетрамер содержит одну молекулу биотина и один ион Mn2+.
Для П. характерна аллостерич. регуляция активности (регуляторный участок находится
не на той субъединице, где находится активный центр фермента).
Р-ция, катализируемая П.,-наиб.
важная в обеспечении пополнения промежут. в-вами трикарбоновых кислот цикла
(такие р-ции наз. анаплеротическими), имеет большое значение для глюконеогенеза
.
Аллостерич. регулятор (активатор)
р-ции-ацетил-кофер-мент А. Под его влиянием происходит ассоциация малоактивных
тетрамеров в нативную молекулу П. (на холоду фермент диссоциирует на 4 тетрамера).
Избыток активатора стимулирует образование в митохондриях щавелевоуксус-ной
к-ты, что, в свою очередь, обусловливает увеличение скорости синтеза из последней
и ацетил-кофермента А лимонной к-ты.
У бактерий и зеленых растений
синтез щавелевоуксусной к-ты происходит с помощью др. фермента - фосфоенол-пируваткарбоксилазы.
Лит.: Диксон M.,
Уэбб Э., Ферменты, пер. с англ., т. 2, гл. 10, M., 1982, с. 732-75; Страйер
Л., Биохимия, пер. с англ., т. 2, M., 1985, с. 107-109.
3. С. Kaгaн.
|

