ПЛАЗМОХИМИЯ
, изучает
кинетику и механизм хим. превращений и физ.-хим. процессов в низкотемпературной
плазме
. Низкотемпературной принято считать плазму с т-рой 103-105
К и степенью ионизации 10-6-10-1, получаемую в электродуговых,
высокочастотных и СВЧ газовых разрядах, в ударных трубах, установках адиабатич.
сжатия (см. Адиабатического сжатия метод
)и др. способами. В П. особенно
важно разделение низкотемпературной плазмы на квазиравновесную, к-рая существует
при давлениях порядка атмосферного и выше и характеризуется общей для всех частиц
т-рой, и неравновесную, к-рая м. б. получена при давлениях менее 30 кПа и в
к-рой т-ра своб. электронов значительно превышает т-ру тяжелых частиц (молекул,
ионов). Это разделение связано с тем, что кинетич. закономерности квазиравновесных
плазмохим. процессов определяются только высокой т-рой взаимодействующих частиц,
тогда как специфика неравновесных плазмохим. процессов обусловлена гл. обр.
большим вкладом хим. р-ций, инициируемых "горячими" электронами.
Квазиравновесные плазмохимические
процессы. В практически интересной области т-р (3-5) · 103 К
хим. р-ции протекают со столь высокими скоростями, что их характерные времена
tx становятся одного порядка с характерными временами tп
процессов тепло- и массопереноса, т.е. критерий Дамкёлера [Дамкелера] 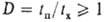 (см. Макрокинетика
). В результате процессы могут переходить из кинетич.
области протекания в диффузионную. Механизмы р-ций также могут претерпевать
значит. изменения; в частности, могут играть существ. роль р-ции с участием
частиц, возбужденных по внутр. степеням свободы. Плазму в этом случае рассматривают
либо как эффективный энергоноситель, либо как источник химически активных частиц
(атомов, радикалов, возбужденных частиц), но чаще всего — в том и другом качествах
одновременно. Анализ кинетики плазмохим. процессов проводят с учетом газодинамич.
особенностей течения реагирующей
смеси в реакторе, тепло- и массообмена, как правило, в условиях интенсивной
турбулентности и при наличии возвратных течений в канале реактора (см. Плаз-мохимическая технология). В тех случаях, когда целевой продукт процесса находится в области
равновесного протекания р-ции, при исследовании процесса может оказаться достаточным
применение термодинамич. анализа. Классич. пример подобного процесса - фиксация
атм. азота в электродуговых плазмотронах.
(см. Макрокинетика
). В результате процессы могут переходить из кинетич.
области протекания в диффузионную. Механизмы р-ций также могут претерпевать
значит. изменения; в частности, могут играть существ. роль р-ции с участием
частиц, возбужденных по внутр. степеням свободы. Плазму в этом случае рассматривают
либо как эффективный энергоноситель, либо как источник химически активных частиц
(атомов, радикалов, возбужденных частиц), но чаще всего — в том и другом качествах
одновременно. Анализ кинетики плазмохим. процессов проводят с учетом газодинамич.
особенностей течения реагирующей
смеси в реакторе, тепло- и массообмена, как правило, в условиях интенсивной
турбулентности и при наличии возвратных течений в канале реактора (см. Плаз-мохимическая технология). В тех случаях, когда целевой продукт процесса находится в области
равновесного протекания р-ции, при исследовании процесса может оказаться достаточным
применение термодинамич. анализа. Классич. пример подобного процесса - фиксация
атм. азота в электродуговых плазмотронах.
Неравновесные плазмохимические
процессы. Энергия электрич. поля газового разряда передается электронам,
к-рые отдают ее др. частицам плазмы при столкновениях. При упругих столкновениях
вследствие относительно малой массы электронов эффективность передачи энергии
тяжелым частицам невелика; кроме того, при пониж. давлениях среднее число столкновений
частиц в единицу времени вообще относительно мало. Это приводит к тому, что
средняя энергия электронов существенно превышает среднюю энергию тяжелых частиц.
Так, в плазме тлеющего разряда в газах при давлениях 10—103 Па средняя
энергия электронов составляет обычно 3-10 эВ, тогда как поступат. энергия тяжелых
частиц и вращат. энергия молекул не превышают 0,1 эВ; в то же время колебат.
энергия молекул может приближаться к средней энергии электронов.
При указанных энергиях
электронов возрастает число их неупругих столкновений с тяжелыми частицами,
приводящих к хим. р-циям (в т.ч. к ионизации) и возбуждению частиц по внутр.
степеням свободы, гл. обр. электронным. В свою очередь, ионы и возбужденные
частицы (особенно в метастабильных электронных состояниях) могут оказывать определяющее
влияние на механизм и кинетику плазмохим. р-ций. Скорости р-ций с участием возбужденных
частиц, ионов и радикалов превышают, как правило, скорости образования этих
частиц, поэтому суммарная скорость хим. превращения лимитируется именно стадией
образования. В лаб. установках низкотемпературная плазма ограничена твердыми
стенками сосуда, в к-ром она генерируется, и при пониж. давлениях характерные
времена диффузии частиц к стенкам сосуда сближаются с характерными временами
хим. р-ций. В результате роль гетерог. физ.-хим. процессов возрастает в такой
мере, что их необходимо учитывать при анализе механизмов и кинетики плазмохим.
р-ций.
Среди р-ций, протекающих
в неравновесной плазме, наиб. распространены диссоциативная ионизация молекул,
диссоциация через электронно-возбужденные состояния, диссо-циативное прилипание
электронов к молекулам, ступенчатая диссоциация электронным ударом, диссоциативная
рекомбинация при столкновениях мол. ионов с электронами и тяжелых частиц между
собой (см. Ионы в газах
). Часто наиб. интерес представляют именно гетерог.
процессы, напр. образование (или травление) пленок разл. природы на внутр. пов-сти
реактора или на помещенных в плазму подложках. И без того нелегкая задача анализа
кинетики и механизмов хим. р-ций осложняется тем, что, как правило, энергетич.
распределение электронов существенно отличается от макс-велловского (особенно
в высокоэнергетич. области, наиб, важной с точки зрения П.), а заселенность
квантовых уровней частиц во мн. случаях не описывается ф-лой Больцмана. Плазмохим.
р-ции являются в осн. многоканальными процессами; число реализующихся каналов
и их детальные механизмы могут претерпевать существ. изменения при изменении
параметров плазмы (уд. энергии, степени ионизации, давления, состава). При проведении
хим. р-ций в условиях неравновесной плазмы собственно реактор и генератор плазмы
в большинстве практически интересных случаев совмещены. Это требует учета влияния
электромагн. полей на св-ва плазмы и, следовательно, на кинетику и механизмы
плазмохим. р-ций. Протекание р-ций в условиях неравновесной плазмы описывается
неравновесной химической кинетикой
.
Характерный пример плазмохим.
процесса в неравновесной плазме - образование твердой пленки полимера на стенках
плазмохим. реактора и помещаемых в него подложках в плазме
тлеющего разряда в смесях углеводородов с инертными газами. Осн. канал диссоциации
молекул исходного углеводорода - их возбуждение в нестабильные и предиссо-циирующие
электронные состояния посредством прямого электронного удара. В области давлений
от 10 до 103 Па, при уд. мощностях плазмы от 5 до 20 Вт/см3,
относит. концентрации углеводородов в инертных газах от 0,1 до 10% по объему
и временах пребывания в плазме от 5 мс до 100 с диссоциацией через колебат.
возбуждение можно пренебречь, а вклад диссоциации в ионно-молекулярных реакциях
становится существенным лишь вблизи ниж. границ указанных областей изменения
давления и концентрации углеводородов. При уменьшении давления распределение
электронов по энергиям - осн. кинетич. параметр неравновесной плазмы - обогащается
в области больших энергий, в результате чего увеличивается константа скорости
диссоциации молекул углеводородов, слабо зависящая от природы исходного углеводорода
(в ряду CH4, C2H6, C3H8,
C4H10, C5H12 и т.д.). Предложенные
механизмы образования и роста полимерной пленки весьма сложны. Согласно одной
из гипотез, все продукты диссоциации исходного углеводорода в газовой фазе переходят
в пленку; в рамках др. гипотезы адсорбированные на пов-сти твердой подложки
или уже образовавшейся пленки молекулы "пришиваются" к последней
потоками ионов и электронов. Результаты измерений скорости роста пленки попадают
в область между результатами расчетов, соответствующих указанным гипотезам.
Лит.: Теоретическая
и прикладная плазмохимия, M., 1975; Словец-кий Д. И., Механизмы химических реакций
в неравновесной плазме, M., 1980; Синтез соединений в плазме, содержащей углеводороды,
M., 1985; Механизмы плазмохимических реакций углеводородов и углеродсодержащих
молекул, ч. 1-2, M., 1987; Полак Л. С., [и др.], Химия плазмы, Новосиб., 1991.
А. А. Овсянников.
|

