ПОЛИРЕКОМБИНАЦИЯ
, процесс
образования полимеров рекомбинацией своб. радикалов, генерируемых действием
орг. пероксида на мономер, находящийся в жидком состоянии:
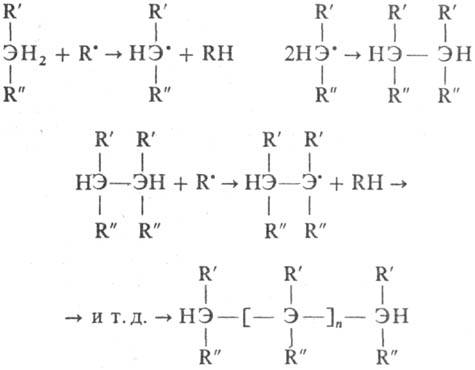
(R и R:-Ar, Alk,
нитрильная, сложноэфирная или др. группа; R·-своб. радикал, образующийся
при термолизе орг. пероксида; Э-С, Si, Ge).
Мономерами для П. служат
соед., содержащие подвижный атом водорода: арилалканы (напр., дифенилметан),
нитрилы (нитрил фенилуксусной к-ты), сложные эфиры (бензил-бензоат), кетоны
(бензилметилкетон), элементоорг. соед. (дифенилсилан) и др.
Механизм детально изучен
на примере П. дифенилметана, превращаемого в полимер при 200 °С под действием
трет-
бутилпероксида. Возникающие при термораспаде пероксида "первичные"
своб. радикалы (трет
-бутоксильные или ме-тильные) отрывают атомы Н от
метиленовых групп дифенилметана, превращаясь в трет
-бутанол или метан.
Образующиеся при этом "вторичные" своб. радикалы - дифенил-метильные
- рекомбинируют, давая димер - тетрафенил-этан. Многократное повторение этого
процесса приводит к образованию три-, тетра- и др. меров и в конечном счете
- полимера с мол. м. (5-50)·103.
Миним. кол-во орг, пероксида,
необходимое для образования полимера, должно быть не менее эквимолярного по
отношению к мономеру. Однако из-за участия первичных своб. радикалов в побочных
р-циях расход пероксида оказывается больше. При П. дифенилметана макс. мол.
масса полидифенилметилена достигается при двукратном молярном избытке пероксида.
Механизм роста цепи (ступенчатый
характер, образование низкомол. продуктов р-ции) позволяет рассматривать П.
как радикальную поликонденсацию.
Диспропорционирование вторичных
своб. радикалов может привести к изменению механизма роста цепи.
Преимущество П.: возможность
получения полимеров из мономеров, к-рые не имеют "классич." функц.
групп (дифенилметан). В пром-сти П. для получения полимеров не используют.
П. открыта в 1957 В. В.
Коршаком и С. Л. Сосиным.
Лит.: Коршак В.
В., Виноградова С. В., Неравновесная поликонденсация, М., 1972. В. А. Васнев.
|

