ПОЛУПРОВОДНИКИ
,
в-ва, характеризующиеся увеличением электрич. проводимости с ростом т-ры. Хотя
часто П. определяют как в-ва с уд. электрич. проводимостью а, промежуточной
между ее значениями для металлов (s ! 106 -104
Ом-1 см-1) и для хороших диэлектриков (s !
10-12 — 10-10 Ом-1 см-1), сама величина
электрич. проводимости не играет определяющей роли в полупроводниковых св-вах
в-ва. На электрич. проводимость П оказывает влияние кроме т-ры сильное электрич.
поле, давление, воздействие оптич. и ионизирующего излучения, наличие примесей
и др. факторы, способные изменять структуру в-ва и состояние электронов. Это
обстоятельство играет решающую роль в многочисленном и разнообразном использовании
П.
Полупроводниковые св-ва
могут наблюдаться как в кристаллич. в-вах, так и в неупорядоченных системах
- твердых аморфных в-вах (стеклах) и жидкостях. При этом решающим является характер
хим. связи между частицами в ближнем порядке (первая координац. сфера). Существуют
П. с любым типом хим. связи, кроме чисто металлической и чисто ионной (т.е.
ковалентной, ковалентно-металлич., ковалентно-ионной и т.п.), причем ковалентная
составляющая связи является обычно преобладающей. Широкое практич. применение
получили П., являющиеся простыми в-вами (Ge, Si и др.), а также хим. соединения
элементов III гр. периодич. системы с элементами V гр., напр. GaAs, GaP, InAs,
CdTe и т.п. (бинарные П.). Все такие в-ва имеют кристаллич. решетку, подобную
решетке алмаза, и наз. алмазоподобными П. В Ge и Si в кристаллич. состоянии
реализуется классич. двухэлектронная ковалентная связь. образованная перекрыванием
sp3-гибридных орбиталей соседних атомов (см. Гибридизация атомных орбиталей
). В соответствии с симметрией sp3-гибридных
орбиталей расположение атомов в первой координац. сфере отвечает правильному
тетраэдру. Такова же первая координац. сфера и у алмазоподобных П., однако в
их структуре каждая ковалентная связь имеет ковалентно-ионный характер из-за
заметной разности электроотрицательностей соседних атомов.
Повышение т-ры, а также
др. внеш. воздействия (облучение светом или сильное электрич., поле) могут вызвать
разрыв ковалентной связи, ионизацию атомного остова и образование своб. электрона.
Этот электрон в условиях непрерывного обмена валентными электронами между атомами
кристалла может переходить из ячейки в ячейку и переносить с собой отрицат.
заряд, к-рый повсюду является избыточным, т.е. своб. электрон становится электроном
проводимости. Недостаток электрона у разорванной ковалентной связи становится
блуждающей по кристаллу дыркой, с к-рой связан единичный положит. заряд.
Электроны проводимости
и дырки-два типа своб. носителей заряда в П. В идеальных кристаллах их концентрации
равны, т.к. превращение одного из валентных электронов в электрон проводимости
неизбежно вызывает появление дырки. Электропроводность П. ст, обусловленная
электронами атомов данного в-ва (т. наз. собственная проводимость), определяется
помимо концентрации носителей п их подвижностью m-отношением скорости
направленного движения, вызванного электрич. полем (дрейфовой скоростью) uдр,
к напряженности поля Е:
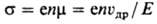
(е-элементарный электрич.
заряд).
Подвижность разных носителей
в идеальном кристалле определяется процессами рассеяния электронов на тепловых
колебаниях решетки, поэтому ц сильно зависит от т-ры. При 300 К подвижность
носителей в твердых П. варьируется в широких пределах от 105 см2/с
до 10-3 см2/с и меньше. В реальных кристаллах при пониж.
т-рах, как правило, преобладает рассеяние носителей на дефектах кристаллич.
структуры.
Примесная проводимость.
В реальных кристаллах источниками своб. носителей заряда (носителей тока)
м. б. дефекты кристаллич. структуры, напр. междоузельные атомы, вакансии, а
также отклонения от стехиометрич. состава. Примеси и дефекты делятся на доноры
и акцепторы. Доноры отдают в объем П. избыточные электроны, создавая электронную
проводимость (n-типа). Акцепторы захватывают валентные электроны собств.
атомов П., в результате чего образуются дырки и возникает дырочная проводимость
(р-типа). Типичными донорами в Ge и Si являются примесные атомы элементов
V гр. (Р, As, Sb). В узле кристаллич решетки 4 из 5 валентных электронов такого
атома образуют ковалентные связи с соседними атомами Ge или Si, а 5-й электрон
оказывается слабо связанным с примесным ионом. Энергия ионизации примеси мала
(~0,01 эВ в Ge и 0,04 эВ в Si), поэтому уже при 77 К в П. появляются электроны
проводимости в концентрации, определяемой содержанием примеси
Аналогично атомы III гр.
(В, Al, Ga, In)-типичные акцепторы в Ge и Si. Дырка, к-рая остается в месте
захваченного примесью валентного электрона Ge или Si, очень слабо связана с
примесным ионом и при не очень низких т-рах легко превращ. в своб. носитель
заряда (носитель тока). Во мн. бинарных П. типа AIVBVI
источниками дырок являются вакансии атомов AIV, а вакансии BVI
источниками электронов проводимости. Электропроводность П., определяемая электронами
примесных атомов, наз. примесной проводимостью, а введение определенных примесей
для получения П. с разл. требуемыми св-вами-легированием П.
Зонная теория объясняет
полупроводниковые св-ва твердых тел на основе одноэлектронного приближения и
распределения электронных энергетич. уровней в виде разрешенных и запрещенных
зон (см. Твердое тело
). Энергетич. уровни электронов, участвующих
в ковалентной связи, образуют верхнюю из заполненных разрешенных зон (валентную
зону). Следующая по энергии разрешенная зона, уровни к-рой не заполнены электронами,-зона
проводимости. Энергетич. интервал между "дном" Ес
(минимумом энергии) зоны проводимости и "потолком" Еу
(максимумом) валентной
зоны наз. шириной запрещенной зоны DE (см. рис.). Для разных П.
ширина запрещенной зоны меняется в широких пределах. Так, при T:
0 К DE = 0,165 эВ в PbSe и 5,6 эВ в алмазе.
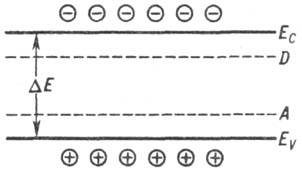
Валентная зона (кружки
с плюсом дырки) и зона проводимости (кружки с минусом-электроны проводимости):
Eс-дно зоны проводимости, EV-потолок валентной
зоны, DE-
ширина запрещенной зоны, D и A-донорные и акцепторные
уровни соответственно.
Тепловое движение переносит
часть электронов в зону проводимости; в валентной зоне при этом появляются дырки
- квантовые состояния, не занятые электронами. Обычно электроны занимают уровни,
расположенные вблизи дна Ес зоны проводимости, а дырки-уровни,
расположенные вблизи потолка EV валентной зоны. Расстояния
от этих уровней соотв. до Ес и ЕV порядка
энергии теплового движения kТ, т. е. гораздо меньше ширины разрешенных
зон (k-постоянная Больцмана). Локальные нарушения идеальности кристалла
(примесные атомы, вакансии и др. дефекты) могут вызвать образование разрешенных
локальных уровней энергии внутри запрещенной зоны.
При т-рах вблизи О К все
собств. электроны П. находятся в валентной зоне, целиком заполняя ее, а примесные
электроны локализованы вблизи примесей или дефектов, так что своб. носители
заряда отсутствуют. С повышением т-ры тепловое движение "выбрасывает"
в зону проводимости преим. электроны примесных атомов-доноров, поскольку энергия
ионизации донора меньше ширины запрещенной зоны. Концентрация электронов в зоне
проводимости при этом во много раз больше концентрации дырок в валентной зоне.
В таких условиях электроны наз. основными носителями в П. n-типа, аналогично
дырки - основными носителями в П. р-типа. После полной ионизации всех
доноров доминирующим процессом оказывается выброс из валентной зоны в зону проводимости
собств. электронов П При нек-рой т-ре их концентрация в зоне проводимости становится
сравнимой с концентрацией примесных электронов, а потом и во мн. раз большей.
Это температурная область собств. проводимости П., когда концентрации электронов
п и дырок р практически равны.
Возникновение пары электрон
проводимости-дырка наз. генерацией носителей заряда. Возможен и обратный процесс-рекомбинация
носителей заряда, приводящая к возвращению электрона проводимости в валентную
зону и исчезновению дырки. Рекомбинация носителей может сопровождаться выделением
избыточной энергии в виде излучения, что лежит в основе полупроводниковых источников
света и лазеров
Электроны проводимости
и дырки, возникновение к-рых явилось следствием тепловых флуктуации в условиях
тер-модинамич. равновесия, наз. равновесными носителями заряда. При наличии
внеш. воздействия на П. (освещение, облучение быстрыми частицами, наложение
сильного электрич. поля) может происходить генерация носителей заряда, приводящая
к появлению избыточной (относительно термодинамически равновесной) их концентрации.
При появлении в П. неравновесных носителей возрастает число актов рекомбинации
и захвата электрона из зоны проводимости на примесный уровень в запрещенной
зоне ("захват" носителей). После прекращения внеш. воздействия концентрация
носителей приближается к равновесному значению.
p-n-Переход в
П. В объеме одного и того же П. возможно создание двух областей с разными
типами проводимости, напр. легированием донорной примесью (p-область)
и акцепторной примесью (n-область). Т к. в р-области концентрация
дырок выше, чем в n-области, происходит диффузия дырок из р-области
(в ней остаются отрицательно заряженные акцепторные ионы) и электронов из л-области
(в ней остаются положительно заряженные донорные ионы). На границе областей
с р-
и n-проводимостью образуется двойной слой пространств, заряда,
и возникающая электрич. разность потенциалов препятствует дальнейшей диффузии
осн. носителей тока. В условиях теплового равновесия полный ток через p-n-переход
равен нулю. Внеш. электрич. поле нарушает равновесие, появляется отличный от
нуля ток через переход, к-рый с ростом напряжения экспоненциально возрастает.
При изменении знака приложенного напряжения ток через переход может изменяться
в 105-106 раз, благодаря чему p-n-переход является
вентильным устройством, пригодным для выпрямления переменного тока (полупроводниковый
диод). На св-вах p-n-перехода основано применение П. в качестве разл.
рода датчиков - т-ры, давления, освещения, ионизирующих излучений (см. Радиометрия
).
Классификация. В
соответствии с зонной теорией различие между П. и диэлектриками чисто количественное
- в ширине запрещенной зоны. Условно считают, что в-ва с DE >
2 эВ являются диэлектриками, с DE < 2 эВ - полупроводниками.
Столь же условно деление П. на узкозонные (DE < 0,1 эВ) и широкозонные.
Важно, что один и тот же по хим. составу материал в зависимости от внеш. условий
(прежде всего т-ры и давления) может проявлять разные св-ва. Наблюдается определенная
зависимость между концентрацией электронов проводимости и устойчивостью кристаллич.
структуры П. В частности, алмазоподобная структура устойчива до тех пор, пока
в зоне проводимости еще остаются вакантные энергетич. уровни. Если все они оказываются
занятыми и имеет место вырождение энергетических уровней
, первая координац.
сфера, а за ней и весь кристалл претерпевают перестройку с образованием более
плотной структуры, характерной для металлов. При этом концентрация электронов
проводимости перестает расти с т-рой и собств. проводимость П. падает. Классич.
примером является олово, устойчивая полиморфная модификация к-рого (белое олово)
при комнатной т-ре является металлом, а стабильное при т-рах ниже 13°С серое
олово (ct-Sn)- узкозонный П. С повышением т-ры и соответствующим изменением
концентрации своб. электронов характерная для a-Sn алмазоподобная структура
переходит в структуру с более плотной упаковкой атомов, свойственной металлам.
Аналогичный переход П.-металл наблюдается при высокой т-ре у Ge, Si и алмазоподобных
бинарных П., к-рые при плавлении теряют полупроводниковые св-ва.
В рамках зонной теории
аморфные (стеклообразные и жидкие) П. можно рассматривать как немолекулярные
системы, в к-рых из-за многообразия положений и взаимных ориентации атомов и
атомных групп положения дна (по энергии) зоны проводимости и потолка валентной
зоны испытывают флуктуации порядка ширины запрещенной зоны. В силу этого среднестатистич.
энергетич. (потенциальный) рельеф краев зон имеет сложную форму, электроны в
зоне проводимости и дырки в валентной зоне локализуются в потенц. ямах ("каплях"),
разделенных разновысокими потенц. барьерами. Проводимость в таких системах обусловлена
спонтанным перебросом носителей тока через барьер или квантовым туннелированием.
К таким П. относятся халькогенидные стекла, сохраняющие полупроводниковые св-ва
в жидком состоянии.
В кристаллических П., имеющих
цепочечную (Se, Те) или слоистую структуру (нек-рые модификации As и Sb), зонная
структура, а следовательно, ширина запрещенной зоны различны в разных кристаллографич.
направлениях, что обусловлено неодинаковым характером хим. связи. Выделяют гомодесмические
П. с высокосимметричной структурой (Ge, Si, алмазоподобные бинарные и многокомпонентные
соед.) и гетеродесмические П. (цепочечной и слоистой структур, напр. Se, Те,
GeAs, GeAs2). Сама величина собств. проводимости П. и ее температурная
зависимость в разных кристаллографич.
направлениях для этих в-в (или фаз) будут отличаться.
П. и периодическая система
элементов. Элементы, проявляющие полупроводниковые св-ва в виде простых
в-в, расположены компактной группой в периодич. системе (в табл. они выделены
сплошной ломаной линией). Все они являются p-элементами, в атомах к-рых
постепенно заполняются электронами p-орбитали. Собств. проводимость проявляется
у в-в, структура к-рых допускает образование насыщ. (двухцентровых) ковалентных
связей. В простых в-вах с валентными s-
и p-электронами выполняется
т. наз. правило октета, согласно к-рому каждый атом имеет (8 — N)
ближайших соседей (N —
номер группы). Так, в П. группы IVa координац.
число равно 4 (тетраэдр). У полупроводниковых модификаций простых в-в группы
Va-P, As, Sb-координац. число равно 3, что способствует формированию слоистых
структур. S, Se, Те (гр. VIa) в полупроводниковом состоянии имеют координац.
число 2 и образуют линейные, цепочечные структуры, связанные в трехмерную сетку
силами Ван-дер-Ваальса. У полупроводниковой модификации I (гр. VIIa) координац.
число равно 1 и сохраняется мол. структура с бинарными молекулами I2 в
узлах кристаллич. решетки. В периодич. системе все элементы, образующие полупроводниковые
фазы, кроме В (гр. IIIa), расположены правее т. наз. границы Цинтля, к-рая разделяет
элементы с дефицитом валентных электронов (менее 4 электронов на атом) и элементы,
у к-рых достаточное число валентных электронов для образования ковалентных связей
в структурах простых в-в в соответствии с правилом октета.
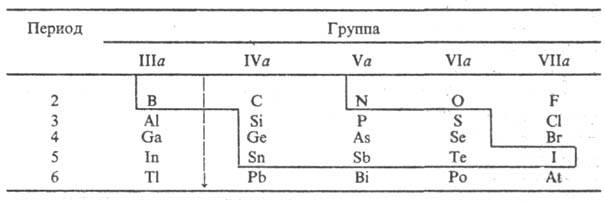
Граница Цинтля
В бинарных соед. между
элементами, расположенными левее границы Цинтля, и элементами, стоящими вправо
от нее, реализуются полярные ковалентные связи. Обычно более электроотрицат.
атом наз. "анионообразователем", более электроположительный - "катионообразователем".
Эти соед. проявляют полупроводниковые св-ва в том случае, если орбитали анионообразователя
полностью заселены электронами. Полупроводниковые соед. подчиняются модифицированному
правилу октета, согласно к-рому отношение числа пе валентных
электронов, приходящихся на одну формульную единицу, к числу па
атомов элемента групп IVa-VIIa равно 8. Состав таких соед. строго подчиняется
правилам формальной валентности. Наиб. интерес представляют бинарные алмазоподобные
фазы, в состав к-рых входят элементы групп, равноотстоящих от гр. IVa. Они образуют
т. наз. изоэлектронные ряды Si, Ge и a-Sn, члены к-рых представляют бинарные
соед., в к-рых приходится по 8 валентных электронов на одну формульную единицу:
ряд Si: A1P MgS NaCl
ряд Ge: GaAs ZnSe CuBr ряд a-Sn: InSb CdTe Agl
Из перечисленных соед.
большинство имеет тетраэдрич. структуру (координац. число 4), лишь MgS и NaCl
кристаллизуются в структуре с координац. числом 6, характерной для бинарных
ионных кристаллов, и являются диэлектриками. Полупроводниковые соед. могут образовываться
и при др. сочетаниях элементов, находящихся по разные стороны границы Цинтля
(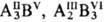 и т.п.).
и т.п.).
Существуют фазы, в структуре
к-рых в первой координац. сфере реализуются связи не только между разными атомами,
но и между одинаковыми, в силу чего их состав не подчиняется правилам формальной
валентности. Если ка-тионообразователем является элемент групп Ia-IIIa и в структуре
фазы имеются хим. связи между атомами этого элемента, то фаза является металлидом
(напр., Сu3Р, Cu3As). Если же катионообразователь - элемент
групп IVa или Va, наличие связи между его атомами не приводит к появлению металлич.
св-в. П. являются и т. наз. анионо-избыточные фазы со связями между атомами-анионообра-зователями.
Т. обр., П. являются GeAs и GeAs2 (одна связь Ge—Ge и одна связь
As—As на одну формульную единицу). Принадлежность бинарной фазы к П. регламентируется
формальным правилом Музера-Пирсона (еще одна модификация правила октета): пе/па
+ Ва = 8, где Ва-число связей между анионообразователями.
В структуре, удовлетворяющей этому правилу, координац. сферы каждого компонента
формируются с помощью двухэлектрон-ных связей.
Представления, основанные
на правиле насыщения первой координац. сферы, оказались плодотворными для прогнозирования
полупроводниковых св-в большого числа соед., не только бинарных, но и многокомпонентных.
Путем замещения компонентов бинарного полупроводникового соед. атомами такой
же валентности (изовалентное замещение) или др. валентности (гетеровалентное
замещение) можно получать непрерывные и ограниченные твердые р-ры с полупроводниковыми
св-вами. Примером могут служить твердые р-ры GaP-GaAs, AlP-GaP и др. Тройные
полупроводниковые соед. получают путем замещения двух атомов одного сорта в
соед. типа AIIIBV на два атома с той же суммарной валентностью.
Напр., при замещении двух атомов алюминия в А1Р (суммарная валентность 3 + 3
= 6)на атомы Mg и Si (та же суммарная валентность 2 + 4 = 6) получают
алмазоподобное тройное полупроводниковое соед. MgSiP2. Подобными
фазами являются ZnGeAs2, CdSnP2 и т.п., это т. наз. изоэлектрон-ное
замещение.
Особую группу в-в, способных
проявить полупроводниковые св-ва, составляют соед. переходных металлов с элементами,
расположенными справа от границы Цинтля. Эти соед. чрезвычайно многообразны
по составу и св-вам из-за поливалентности переходных d- и f-металлов.
В ряде случаев в реальных структурах возможно координац. насыщение хотя бы одного
компонента вследствие образования двух-электронных ковалентных связей. В результате
снимается вырождение энергетич. уровней кристалла и в-во становится П. Поскольку
все элементы групп IVa--VIa принадлежат к числу достаточно высоко электроотрицательных,
выполнение отмеченного выше условия возможно у халькоге-нидов, фосфидов, арсенидов,
силицидов, особенно высших, т.е. содержащих достаточное кол-во анионообразователей
в одной формульной единице. Полупроводниковыми св-вами обладают халькогениды
состава MX и МХ2, пник-тидьт (фосфиды и арсениды) этого же состава,
высшие силициды (если они не являются фазами внедрения). Карбиды состава М2С,
МС и нек-рые другие, как правило, метал-лоподобны вследствие того, что они являются
фазами внедрения, т. е. у них сохраняется кристаллич. каркас металлич. компонента
и, следовательно, преобладает металлич. характер хим. связи. Германиды, станниды,
многие (даже высшие) антимониды также представляют собой металлы, поскольку
входящие в их состав анионообразователи недостаточно электроотрицательны.
Характерной особенностью
практически всех бинарных соед. переходных металлов с элементами групп IVa-VIa
с полупроводниковыми св-вами является наличие вырождения энергетич. уровней
при низких т-рах. Так, даже такие ярко выраженные П., как высшие силициды CrSi2,
ReSi2, Mn4Si7, обнаруживают положит. коэффициент
электрич. проводимости только при высоких т-рах. Это связано не столько с наличием
легко ионизуемых примесей, сколько с
дополнит. возможностью ионизации атомного остова переходного металла, обусловленной
его поливалентностью. В ряде случаев этот процесс затягивается вплоть до т-ры
плавления материала, к-рый так и не становится собственным П.
Органические П. принципиально
отличаются от неорганических П. Все твердые неорганические П. образуют координац.
соединения, в то время как органические П.-молекулярные кристаллы
. Они
так же, как и неорганические П., обладают положит. температурным коэф. проводимости,
но механизм проводимости иной. Для органических П. характерны многоцентровые
связи, характеризующиеся делокализацией p-электронов и проявлением коллективного
электронного взаимод. по системе сопряжения. Делокализация электронов сопровождается
выигрышем энергии, наз. энергией сопряжения; это приводит, в частности, к уменьшению
энергетич. щели DЕ между основным и низшим возбужденным состояниями
p-электронов по мере увеличения числа сопряженных связей в молекуле. В
полимерах с системой сопряжения в осн. цепи макромолекулы DЕ м.
б. порядка энергии теплового движения kT. Внеш. воздействие (гл. обр.
освещение) вызывает возбуждение в системе p-электронов, к-рое может мигрировать
по кристаллу и при распаде (на дефектах структуры, примесных атомах, а также
при взаимод. друг с другом) дает своб. носители заряда. Проводимость в органических
П. обеспечивается гл. обр. перескоками электронов между состояниями с разной
энергией, причем дефицит энергии покрывается за счет энергии тепловых колебаний
атомов (прыжковая проводимость). С этим связана характерная температурная зависимость
органических П.: при умеренно низких т-рах, когда доминируют прыжки между соседними
состояниями, между уд. электрич. сопротивлением r и т-рой Т наблюдается
зависимость ln r ~ T-1. С понижением т-ры длина прыжка
увеличивается и ln r ~ Тn(п < 1).
Различают четыре вида органических
П.: 1) низкомолекулярные соед. с конденсир. ароматич. ядрами: нафталин, антрацен,
пирен, перилен и т. п. и их производные; 2) соед., содержащие помимо конденсированных
ароматич. ядер открытоцепные участки (красители и пигменты типа хлорофилла,
b-каротина); 3) полимерные материалы (полиэтилен, биополимеры); 4) молекулярные
комплексы с переносом заряда, в к-рых проводимость осуществляется путем перехода
электрона от молекулы-донора к молекуле-акцептору (комплексы ароматич. соед.
с галогенами). Мн. органические П. являются биологически активными в-вами, что,
по-видимому, неразрывно связано с особенностями их электрич. проводимости.
Лит.: Органические
полупроводники, 2 изд., М., 1968; Горюнова Н.А., Химия алмазоиодобных полупроводников,
Л., 1963; У гай Я. А., Введение в химию полупроводников, 2 изд., М., 1975. Я.
А. Угай
, В.З. Анохин.
|

