ПРИЛЕЖАЕВА РЕАКЦИЯ
,
синтез оксиранов взаимодействием олефинов (в т. ч. циклических) с надкислотами:
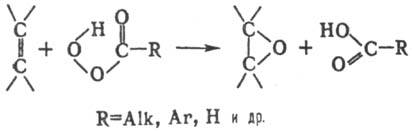
Р-цию осуществляют смешиванием
реагентов, растворенных в инертном р-рителе (гексан, бензол, метиленхлорид,
хлороформ, СС14 и др.) при т-ре от —10 до 60 °С. Выход оксиранов
составляет обычно 60-80%. Электронедонорные заместители ускоряют П. р., электроноакцепторные
- замедляют.
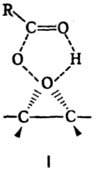
Механизм П. р. включает
электроф. атаку кратной связи алкена атомом кислорода гидропероксидной группы
с образованием циклич. переходного состояния (ф-ла I). П. р. высоко стереоселективна
и приводит обычно к цис
-оксидам с сохранением конфигурации заместителей.
В случае стерич. затруднений
получается смесь изомеров; напр., при эпоксидировании (оксиранировании) 4-метилциклопентена
над-лауриновой к-той в циклопентане или ацетони-триле образуется смесь транс-
и цис
-оксидов в соотношении 3:1. Стереоселективность зависит также
от поляризующего воздействия заместителя. Так, в случае 4-цианоциклопен-тена
в этих же условиях образуется 95 или 76% транс-изомера, если р-цию проводить
соотв. в циклопентане или ацетонитриле. П. р. применяют в лаб. условиях, в т.
ч. для синтеза прир. соед. (углеводов, терпеноидов, стероидов, липидов и др.).
Р-ция открыта Н.А. Прилежаевым в 1909.
Лит.: Сверн Д.,
в сб.: Органические реакции, пер. с англ., сб. 7, М., 1956,с. 476-544; Малиновский
М.С., Окиси олефинов и их производные, М., 1961; Прилежаева Е. Н., Реакция Прилежаева,
М., 1974; Общая органическая химия, пер. с англ., т. 2, М., 1982, с. 376-79;
Sobczak J. М., "Wiad. Chem.", 1985, v. 39, № 10-12, p. 647-65. В.Б.Мочалин.
|

