ПРОТОН
(от греч.
protos- первый), стабильная элементарная частица, входящая в состав всех ядер
атомов хим. элементов; ядро атома самого легкого изотопа водорода 1Н
(протия). Обозначается р. Масса П. mp = 1,6726485(86)x
x10-27кг; в атомных единицах массы
(а.е.м.) 1,007276470(11);
в энергетич. единицах ~938,3 МэВ. Масса П. в ~ 1836 раз больше массы покоя электрона
и немного меньше массы mn нейтрона: mn —
mp = 1,29344 МэВ. Элект-рич. заряд П. положителен, по абс.
величине он равен заряду электрона 1,6021892 (46)·10-19Кл [или 4,803242(14)·10-10
СГСЭ ед. заряда]; уд. заряд П. очень высок-9,578756(27)x x
107·Кл/кг. Спин П. равен 1/2ђ (ђ-постоянная Планка),
магн. момент mр = 2,792763(30)mN, где
mN- ядерный магнетон.
Число П. в ядре атома данного
хим. элемента равно атомному номеру этого элемента и определяет место элемента
в периодической системе химических элементов
. Соотв. все хим. св-ва простых
в-в и соединений, образуемых данным элементом, связаны с числом П. в ядре атома.
Термин "П." ввел Э. Резерфорд в нач. 20-х гг. 20 в.
Согласно классификации
элементарных частиц
, П. относится к адронам, он входит в класс тяжелых
частиц-барионов (П.-самый
легкий из барионов). П. участвует в сильных взаимод., а также во всех др. фундам.
взаимод.: электромагнитном, слабом и гравитационном. В сильном взаимодействии
П. и нейтрон имеют идентичные св-ва и рассматриваются как разл. квантовые состояния
одной элементарной частицы-нуклона. За счет слабых взаимод. в радиоактивных
ядрах возможно превращение П. в нейтрон п, позитрон е+ и нейтрино
v: p:n + e+ + v, а также превращение нейтрона
в П., электрон е- и антинейтрино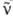 :
n:р+е- +
:
n:р+е- +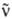 (см. Радиоактивность
). Стабильность П. позволяет использовать их как
бомбардирующие частицы для осуществления ядерных реакций
, причем П. предварительно
ускоряют до высоких скоростей.
(см. Радиоактивность
). Стабильность П. позволяет использовать их как
бомбардирующие частицы для осуществления ядерных реакций
, причем П. предварительно
ускоряют до высоких скоростей.
В химии роль П. особенно
велика в кислотно-основном взаимодействии. Согласно разработанной И. Брёнстедом [Бренстедом]
в 1923 теории к-т и оснований, к-ты-это в-ва, способные отдавать П., а основания-в-ва,
способные принимать П. (см. Кислоты и основания
). Из-за высокого
уд. заряда свободные П. не могут существовать в жидких средах; в водных р-рах.
П. претерпевает гидратацию
. П., входящие в состав разл. протонных р-рителей,
принимают участие в хим. процессах, протекающих в р-рах; р-рители, не содержащие
таких П., наз. апротонными. Важное значение во мн. хим. р-циях имеет присоединение
П. к молекуле в-ва, напр. при нейтрализации, электроф. присоединении и замещении,
образовании ониевых соед. (см. Протонирование
). Р-ции кислотно-основного катализа
зачастую включают стадию переноса П. от субстрата (к-ты или основания)
к катализатору, К-рая наз. протолизом. С. С. Бердоносов
|

