РАСТВОРИТЕЛИ
, неорг.
или орг. соединения, а также смеси, способные растворять разл. в-ва. Для смесей
жидкость-газ и жидкость - твердое тело Р. обычно считают жидкость, для двух-
и многокомпонентных р-ров Р. считают компонент, содержание к-рого существенно
выше содержания остальных компонентов.
Р. могут быть классифицированы
по хим. строению, физ. св-вам и кислотно-основным св-вам.
По хим. строению Р. делят
на органические и неорганические. Органические Р. принадлежат к след. классам
соед.: алифатич. и ароматич. углеводороды (см. также Нефтяные растворители
),
их галогено- и нитропроизводные, спирты, карбоновые к-ты, простые и сложные
эфиры, амиды к-т, нитрилы, кетоны, сульфоксиды и др. Важнейший неорганический
Р.-вода. К неорганическим Р. относят легкоплавкие галогениды (напр., BrF3),
оксогалогениды (напр., сульфу-рилхлорид, тионилхлорид), азотсодержащие Р. (жидкий
NH3, гидразин,
гидроксиламин и др.), а также жидкий SO2, фтористоводородная к-та
и др., в нек-рых случаях применяют легкоплавкие металлы (галлий, олово и др.).
Относительно новая группа неорганических Р.-расплавы солей, к-рые, будучи электролитами,-отличные
Р. для солей и металлов, пригодны также в качестве среды для проведения орг.
р-ций. Используют как легкоплавкие солевые расплавы (нитратные, ацетатные),
так и относительно тугоплавкие (галогенидные, боратные, фосфатные, молибдатные,
вана-датные и т. п.). Широко применяют расплавы оксидов (РbО, Bi2O3,
В2О3), а также смешанные (напр., РbО + PbF2).
Р. можно классифицировать
по физ. св-вам. (Св-ва Р. см. на форзаце в конце тома.) Р. с т-рой кипения ниже
100 °С при 760 мм рт. ст. относят к низкокипящим, с т-рой кипения выше 150°С-к
высококипящим.
По степени летучести Р.
подразделяют на легколетучие, среднелетучие и труднолетучие. Летучесть зависит
от теплоты испарения, а не от т-ры кипения.
По вязкости Р. подразделяют
на маловязкие (менее 2 мПа·с при 20 °С), средней вязкости (2—10 мПа·с) и
высоковязкие (более 10 мПа·с).
В соответствии с наличием
или отсутствием дипольного момента и величиной диэлектрич. проницаемости 8 различают
Р. полярные и неполярные. Кроме того, молекулы Р. могут выступать в качестве
доноров (акцепторов) протонов или электронов. Различают четыре группы Р.: 1)
протонные (вода, спирты, карбоновые к-ты и др.), к-рые являются хорошими донорами
протонов и обладают высокой диэлектрич. проницаемостью (e > 15); 2)
апротонные диполяр-ные (нек-рые апротонные амиды, кетоны, сульфоксиды и др.),
обладающие высокой диэлектрич. проницаемостью, но не обладающие донорно-акцепторными
св-вами; 3) электро-нодонорные (напр., эфиры); 4) неполярные (сероуглерод, углеводороды),
к-рые обладают низкой диэлектрич. проницаемостью (e < 15) и не обладают
донорно-акцепторными св-вами ни по отношению к водороду, ни по отношению к электрону.
О специфич. классификации
Р. для полимеров см. Растворы полимеров
.
К физ. характеристикам
относят также растворяющую способность, определяемую показателем КБ (каури-бута-нол),-кол-во
Р., добавляемого к 20 г 33%-ного р-ра смолы каури в бутиловом спирте до помутнения
р-ра (чем выше КБ, тем растворяющая способность больше).
Р. также классифицируют
в зависимости от их пожаро-и взрывоопасности, токсичности и др.
По кислотно-основным св-вам
Р. могут быть кислотными, основными и нейтральными:
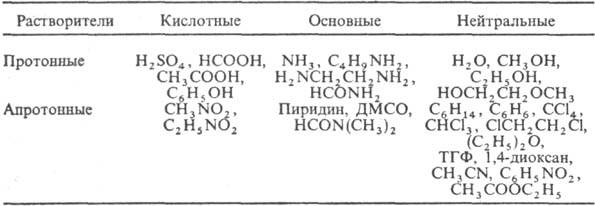
Различают применение Р.
для технол. целей и в качестве среды для проведения хим. р-ций. Как технол.
ср-во Р. используют в лакокрасочной, текстильной, фармацевтич., парфюм., мед.
лром-сти, при произ-ве ВВ, в с. х-ве.
В лакокрасочной пром-сти
Р.-компоненты лакокрасочных материалов, обеспечивающих растворение пленкообразующих
в-в (ксилол, толуол, скипидар, спирты, кетоны, ацетаты и др.), в текстильной
пром-сти Р. используют для крашения, а также для хим. чистки одежды (перхлорэтилен,
1,1,1-трихлорэтан, хладон 113). Широко применяют Р. для обезжиривания металлов
и их сплавов как в условиях холодной очистки (метиленхлорид, спирты, 1,1,1-трихлорэтан,
хладон 113), так и в процессе парожидкостного обезжиривания (трихлорэтилен,
перхлорэтилен, бензин, керосин и
др.). При обезжиривании металлич. пов-стей, особенно состоящих из цветных металлов
или их сплавов, хлоруглево-дороды и нек-рые другие Р. обязательно стабилизируют
спец. в-вами для предотвращения разложения Р.
Очень важна роль Р. как
среды для проведения хим. р-ций. Р. не только создают гомог. среду, обеспечивая
контакт между реагирующими частицами (ионами, молекулами), но и влияют на порядок
и скорость хим. р-ций благодаря взаимод. с исходными, промежут. в-вами и продуктами.
Р. влияют также на хим. равновесие. Так, равновесие диссоциации к.-л. к-ты зависит
от основности или, соотв., кислотности Р., а также от его диэлектрич. проницаемости
и способности Р. сольватировать частицы растворенных в-в (см. Реакции в растворах
,
Сольватация
). Существует ряд эмпи-рич. зависимостей между св-вами
Р. и скоростью и направлением хим. р-ции (см. Корреляционные соотношения
).
В хим. технологии и лаб.
практике Р. используют для процессов перекристаллизации и экстракции, в спектроскопии
и хроматографии, в аналит. химии (напр., для титрования) и др.
Выбор оптимального Р. с
целью его практич. использования определяется суммой разл. факторов: физ. св-вами,
растворяющей способностью, стабильностью при воздействии т-ры, света, влаги,
примесей и т. д., пожаро- и взрывоопасными св-вами, токсичностью, доступностью
и стоимостью.
Проблема утилизации Р.
имеет исключительно важное значение с экономич., санитарно-гигиенич. и экологич.
точек зрения. Наиб. экономичные процессы утилизации Р.-возврат их в рабочий
цикл с помощью рекуперации и регенерации. Рекуперацию Р. (улавливание с возвратом)
осуществляют конденсационным, абсорбционным или адсорбционным методом. Последний
метод получил наиб. распространение. В качестве адсорбентов используют активир.
уголь или др. пористые в-ва (напр., силикагель). Регенерируют Р. перегонкой
(иногда с водяным паром) или ректификацией; образующийся остаток сжигают.
Лит:. Одрит Л.,
Клейнберг Я., Неводные растворители, пер. с англ., М., 1955; Органические растворители,
пер. с англ., М., 1958; Райхардт X., Растворители в органической химии, пер.
с нем., Л., 1973; Энтелис С. Г., Тигер Р. П., Кинетика реакций в жидкой фазе,
М., 1973; Дринберг С. А., Ицко Э.Ф., Растворители для лакокрасочных материалов,
2 изд., Л., 1986; Трегер Ю.А., Карташов Л.М., Кришталь Н. Ф., Основные хлороргани-ческие
растворители, М., 1984; Фиалков Ю.Я., Растворитель как средство управления химическим
процессом, Л., 1990. Ю.А. Трегер.
|

