РЕЛАКСАЦИЯ
(от лат.
relaxatio-ослабление), процесс установления в системе термодинамического равновесия
. Состояние макроскопич. системы определяется мн. параметрами,
и процессы достижения равновесия по разным параметрам могут протекать с разл.
скоростями. Выделяют период линейной Р., когда нек-рый параметр состояния xi лишь незначительно отличается от своего равновесного значения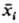 .
В этот период скорость изменения параметра dxi/dt пропорциональна
величине отклонения хi от
.
В этот период скорость изменения параметра dxi/dt пропорциональна
величине отклонения хi от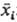 :
:
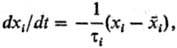
где тi-время
Р. Отсюда следует, что в момент времени t отклонение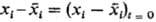 ехр
(—t/тi). За время тi малое
отклонение параметра
хi от равновесного значения уменьшается в е раз. Величины
vi = 1/тi, обратные временам Р., наз.
частотами Р.
ехр
(—t/тi). За время тi малое
отклонение параметра
хi от равновесного значения уменьшается в е раз. Величины
vi = 1/тi, обратные временам Р., наз.
частотами Р.
Времена Р. определяются
св-вами системы и типом рассматриваемого процесса. В реальных системах они могут
варьировать от ничтожно малых величин до значений порядка возраста Вселенной.
Система может достигнуть равновесия по одним параметрам и остаться неравновесной
по другим (частичное равновесие). Все процессы Р. являются неравновесными
и необратимыми и сопровождаются диссипацией энергии, т.е. в системе производится
энтропия (см. Термодинамика необратимых процессов
).
В газах Р. обусловлена
обменом энергией и кол-вом движения при столкновениях частиц, а время Р. определяется
временем своб. пробега (среднее время между двумя последоват. столкновениями
молекул) и эффективностью обмена энергией между всеми степенями свободы сталкивающихся
частиц. В одноатомных газах выделяют этап быстрой Р., когда за короткий период
времени порядка времени столкновения молекул начальное (сильно неравновесное)
состояние хаотизируется настолько, что для его описания достаточно знать, как
изменяется во времени распределение по координатам и импульсам всего одной частицы
(т. наз. одночастичная ф-ция распределения). На втором этапе Р. за время порядка
времени своб. пробега в результате всего неск. столкновений в макроскопически
малых объемах, движущихся со средней скоростью переноса массы (массовая скорость),
устанавливается локальное термодинамич. равновесие. Оно характеризуется параметрами
состояния (т-рой, хим. потенциалом и др.), к-рые зависят от пространств. координат
и времени и медленно стремятся к равновесным значениям в результате большого
числа столкновений (процессы теплопроводности, диффузии, вязкости и т.п.). Время
Р. зависит от размера системы и велико в сравнении со средним временем своб.
пробега.
В многоатомных газах (с
внутр. степенями свободы) м. б. затруднен обмен энергией между поступат. и внутр.
степенями свободы (вращат., колебат.) и возникает Р., связанная с этим явлением.
Быстрее всего устанавливается равновесие по поступат. степеням свободы, к-рое
характеризуется соответствующей т-рой. Равновесие между поступат. и вращат.
степенями свободы устанавливается значительно медленнее. Возбуждение колебат.
степеней свободы возможно лишь при высоких т-рах. Поэтому в многоатомных газах
возможны многоступенчатые процессы Р. (см. Неравновесная химическая кинетика
).
Если газ состоит из компонентов с сильно различающимися по массам молекулами,
замедляется обмен энергий между компонентами, вследствие чего возможны состояния
с разл. т-рами компонент. Напр., в плазме различаются ионные и электронные т-ры
и происходят медленные процессы их Р. (см. Плазмохимия
).
В жидкостях Р. описывают
с помощью пространственно-временных корреляц. ф-ций, характеризующих затухание
во времени и пространстве взаимного влияния молекул (корреляций). Эти корреляции
являются причиной необратимых процессов-теплопроводности и вязкости (см. Жидкость
).
Время Р. к полному термодинамич. равновесию можно оценить с помощью кинетич.
коэффициентов. Напр., в бинарном р-ре время Р. концентрации т ! L2/D,
где L-размер системы, D-коэф. диффузии; время Р. т-ры т !
L2/x, где х-коэф. температуропроводности, и т.д. (подробнее
см. Макрокинетика
).
В твердых телах Р. описывают
как Р. в газе нек-рых квазичастиц. Напр., в кристаллич. решетке при низких т-рах
упругие колебания трактуют как газ фононов (акустическая Р.). В системе спиновых
магн. моментов ферромагнетика квазичастицами являются магноны (магнитная Р.).
При фазовых переходах
Р. может иметь сложный характер. Если переход из неравновесного состояния
в равновесное является переходом 1-го рода, система может перейти сначала в
метастабильное состояние и затем релаксировать чрезвычайно медленно (см. Стеклообразное состояние
). Особенно сложны релаксац. переходы в полимерах, где существует
набор (спектр) релаксац. явлений, каждое из к-рых обусловлено своим механизмом.
В окрестности точки фазового перехода 2-го рода степень упорядоченности фаз
характеризуется параметром порядка, к-рый стремится к нулю, а его время Р. сильно
увеличивается. Еще сложнее характер Р. из состояний, очень далеких от термодинамич.
равновесия. В открытых системах при этом возможны явления самоорганизации
.
Измерения времен Р. используют
в хим. кинетике дли изучения процессов, в к-рых быстро устанавливается равновесие
(см. Релаксационные методы
). Механическая Р. проявляется в уменьшении
во времени напряжения, создавшего в теле деформацию. Механическая Р. связана
с вязкоупру-гостью, она приводит к ползучести, гистерезисным явлениям при деформировании
(см. Реология
). Применительно к биол. системам термин "Р."
иногда используют для характеристики времени жизни системы, к-рая к моменту
физиологической смерти приходит в состояние частичного равновесия (квазиравновесия)
с окружающей средой. В прир. системах времена Р. разделены, сильными неравенствами;
расположение их в порядке возрастания или убывания позволяет рассматривать систему
как последовательность иерархич. уровней с разл. степенью упорядоченности структуры
(см. Термодинамика иерархических систем
).
Лит.: Зубарев Д.
Н., Неравновесная статистическая термодинамика, М., 1971; Лифшиц Е. М., Питаевский
Л. П., Физическая кинетика, в кн.: Теоретическая физика, т. 10, М., 1979; Гладышев
Г. П., Термодинамика и макрокинетика природных иерархических процессов, М.,
1988; Денисов Е. Т., Кинетика гомогенных химических реакций, 2 изд., М., 1988.
|

