РЕНИЙ
(от лат. Rhenus-река
Рейн; Rhenium) Re, хим. элемент VII гр. периодич. системы, ат.н. 75, ат.м. 186,207.
Природный Р. состоит из двух изотопов: стабильного 185Re (37,4%)
и слаборадиоактивного 187Re (62,6%, T1/2 5·Ю10
лет). Поперечное сечение захвата тепловых нейтронов для природного Р.
8,6·10-27 м2.
Конфигурация внеш. электронных
оболочек атома 5d56s2; энергии ионизации
при последоват. переходе от Re0 к Re7+ соотв. 7,88, 16,6,
26,0, 37,7, 51, 64 и 79 эВ; электроотрицательность по Полингу 1,9; сродство
к электрону 0,15 эВ; атомный радиус 0,1373 нм, ионные радиусы (в скобках указано
координац. число) Re4+ 0,077 нм (6), Re5+ 0,072 нм (6),
Re6+ 0,069 нм(6), Re7+ 0,052 (4) и 0,067 нм(6).
Р.-типичный рассеянный
элемент. Его содержание в земной коре 7·10-8% по массе. Самостоят.
минералы Р. не найдены. Повыш. содержание Р. отмечено в колумбите, танталите,
цирконе, минералах РЗЭ, сульфидах Си и Мо (молибдените), а также горючих сланцах.
Мировые запасы Р. (в пересчете на металл) ок. 10 тыс. т, в т. ч. в молибденито-вых
концентратах более 3 тыс. т.
Свойства. Р.-серебристо-серый
металл; кристаллич. решетка гексагональная, а = 0,2760 нм, с =
0,0458 нм, z = 2, пространств. группа Р63/ттс;
т.пл. 3180°С (по тугоплавкости уступает лишь W); т-ра начала рекристаллизации
1550°С; т. кип. 5600 °С; плотн. 21,01 г/см3; 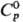 28,43
Дж/(моль·К); DHпл 33,5 кДж/моль, DHвозг
783 кДж/моль (0 К);
28,43
Дж/(моль·К); DHпл 33,5 кДж/моль, DHвозг
783 кДж/моль (0 К);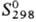 37,2
Дж/(моль·К); ур-ние
температурной зависимости давления пара над жидким P. lgp(Па) = 1,28-39400/T(2348
37,2
Дж/(моль·К); ур-ние
температурной зависимости давления пара над жидким P. lgp(Па) = 1,28-39400/T(2348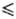 Т
Т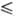 3058
К); температурный коэф. линейного расширения 6,7·10-6 К-1 (293-1273
К); теплопроводность 48,0 Вт/(м·К) при 298 К, 46,6 Вт/(м·К) при 373 К; r
1,93·10-7 Ом·м (20°С), температурный коэф. r 3,9·10-3
К-1; парамагнитен, уд. магн. восприимчивость +0,368·10-6
(20,2 °С); работа-выхода электрона
4,8 эВ. В отличие от W Р. пластичен в литом и рекри-сталлизованном состоянии
и деформируется на холоду. Модуль упругости 470 ГПа при 20 °С (уступает
по величине лишь модулю упругости Os и Iг); твердость по Виккерсу отожженного
Р. 2450 МПа, деформированного-7840 МПа; отличается высокой длит. прочностью
при 1000-2000 °С.
3058
К); температурный коэф. линейного расширения 6,7·10-6 К-1 (293-1273
К); теплопроводность 48,0 Вт/(м·К) при 298 К, 46,6 Вт/(м·К) при 373 К; r
1,93·10-7 Ом·м (20°С), температурный коэф. r 3,9·10-3
К-1; парамагнитен, уд. магн. восприимчивость +0,368·10-6
(20,2 °С); работа-выхода электрона
4,8 эВ. В отличие от W Р. пластичен в литом и рекри-сталлизованном состоянии
и деформируется на холоду. Модуль упругости 470 ГПа при 20 °С (уступает
по величине лишь модулю упругости Os и Iг); твердость по Виккерсу отожженного
Р. 2450 МПа, деформированного-7840 МПа; отличается высокой длит. прочностью
при 1000-2000 °С.
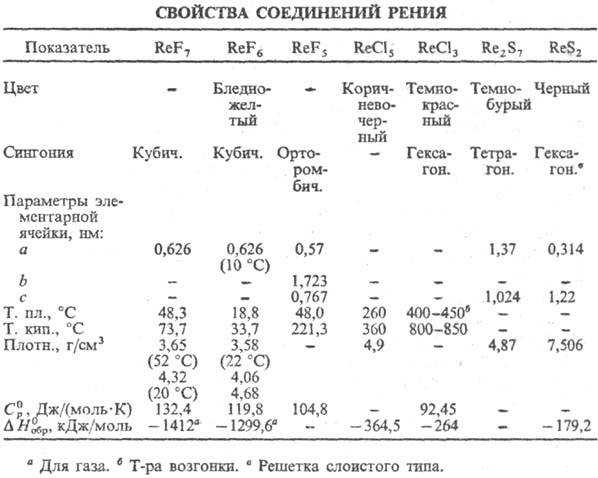
Для Р. известны соединения
со степенью окисления от +7 (наиб. устойчивы) до —1. Оксиды, галогениды,
халькогени-ды и мн. др. соединения Р. восстанавливаются Н2 до металла.
Металлический Р. устойчив на воздухе при комнатной т-ре. Образование оксидов
P. Re2O7, ReO3- начинается при 300 °С и
интенсивно протекает выше 600 °С. Во влажном воздухе Р. медленно окисляется
до HReO4. P. устойчив в атмосфере Н2, а также N2
даже при высоких т-рах. С F2 при нагр. образует смесь ReF5,
ReF6 и ReF7, с Cl2-ReCl5 и ReCl4,
с Br2-ReBr5, с I2 не реагирует. Взаимод. порошков
Р. и графита при 1000°С и давлении 920 кПа получен карбид ReC. С парами
боранов или галогенидов В при 1750°С и выше образует бориды. Р. не корродирует
в H2SO4, соляной и фтористоводородной к-тах при комнатной
т-ре. В HNO3, горячей H2SO4 и в Н2О2
раств. с образованием HReO4. С р-рами щелочей реагирует медленно,
с расплавами быстро (особенно в присут. окислителей), давая ренаты(VII) MReO4.
P. устойчив в расплавл. Sn, Zn, Ag, Си, Bi, слабо раств. в расплавл. А1 и легко-в
расплавах Ni и Fe. При восстановлении аммиаком NH4ReO4
или ReCl3 при 300-350 °С получен нитрид ReN0,43 (решетка
гране-центрированная кубич., а = 0,392 нм; разлагается при нагр. до 280
°С в вакууме).
С фосфором выше 750-800
°С Р. образует фосфиды ReP3, ReP2, ReP и Re2P,
с As-арсенид ReAs2,1-2,3, с Si при спекании-силициды ReSi, Re3Si,
Re2Si, а также ReSi2 (решетка тетрагон., а = 0,3131
нм, с = 0,7676 нм; полупроводник).
Устойчивые сульфиды P.-Re2S7
и ReS2 (см. табл.); окисляются HNO3, H2O2
и др. до HReO4. Сульфид Re2S7 при 500-600 °С
сгорает на воздухе до Re2O7; почти не раств. в воде и
соляной к-те; получают при длит, пропускании H2S через солянокислый
р-р рената(VII) щелочного металла. ReS2 устойчив на воздухе до 180-200
°С, выше 300 °С сгорает до Re2O7; не раств. в
H2SO4, соляной к-те и р-рах щелочей; получают взаимод.
порошка Р. с S при 900-1000 °С в запаянной вакуумированной трубке или атмосфере
инертного газа, а также разложением Re2S7 в вакууме. Известны
также ReS3, Re2S3, ReS, оксисульфиды ReO2S3,
ReOS. Аналогично сульфидам получают селениды Re2Se7 и
ReSe2 (плотн. 8,27 г/см3). Сульфиды и селениды Р.-эффективные
катализаторы гидрирования орг. в-в.
Р.-единств. металл, образующий
устойчивый гептафто-рид ReF7 (см. табл.); т-ра полиморфного перехода
— 110 °С; 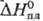 5,45 Дж/моль,
5,45 Дж/моль, 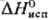 31,8 кДж/моль;
31,8 кДж/моль; 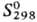 354,9 Дж/(моль·К);
ур-ния температурной зависимости давления пара: lgp(Па) = 5,1524-1,4703
lgT-2205,8/Т (258,68
354,9 Дж/(моль·К);
ур-ния температурной зависимости давления пара: lgp(Па) = 5,1524-1,4703
lgT-2205,8/Т (258,68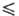 Т
Т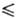 321,45 К), lgp(Пa) = 29,4743 + 9,90825 lgT-244,28/Г(321,45
321,45 К), lgp(Пa) = 29,4743 + 9,90825 lgT-244,28/Г(321,45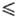 Т
Т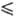 347,76
К); быстро гидролизуется водой до HF и HReO4. Гексафторид ReF6-кубич.
форма переходит в ромбическую при -3,45°С, DHперехода
4,40 кДж/моль,
347,76
К); быстро гидролизуется водой до HF и HReO4. Гексафторид ReF6-кубич.
форма переходит в ромбическую при -3,45°С, DHперехода
4,40 кДж/моль, 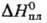 4,56
кДж/моль,
4,56
кДж/моль, 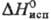 28,3
кДж/моль; легко гидролизуется, во влажном воздухе образует ReO2;
в присут. следов влаги превращ. в ReOF4; хорошо раств. в безводном
HF. Пента-фторид ReF5 (,
28,3
кДж/моль; легко гидролизуется, во влажном воздухе образует ReO2;
в присут. следов влаги превращ. в ReOF4; хорошо раств. в безводном
HF. Пента-фторид ReF5 (,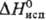 50,3 кДж/моль) взаимод. с СС14, гидролизуется водой; получают восстановлением
ReF6 водородом, Si, W или Re, а также PF3. Тетрафторид
ReF4-кристаллы с тетрагон. решеткой (а = 1,012 нм, с = 1,595 нм); возгоняется выше 300 °С; получают восстановлением ReF6
рением, Н2, SO2 либо при диспропорционировании ReF5.
50,3 кДж/моль) взаимод. с СС14, гидролизуется водой; получают восстановлением
ReF6 водородом, Si, W или Re, а также PF3. Тетрафторид
ReF4-кристаллы с тетрагон. решеткой (а = 1,012 нм, с = 1,595 нм); возгоняется выше 300 °С; получают восстановлением ReF6
рением, Н2, SO2 либо при диспропорционировании ReF5.
Из хлоридов Р. наиб. изучены
ReCl5 и ReCl3, из оксохло-pидов-ReOCl4, ReO3Cl.
Пентахлорид ReCl5 в атмосфере инертного газа выше 600 °С диссоциирует
на Re и С12, при 190-360 °С-на С12 и ReCl3;
во влажном воздухе дымит, в воде диспропорционирует на производные Re(IV) и
Re(VII); при нагр. реагирует с О2 со вспышкой, образуя оксохлори-ды.
Трихлорид ReCl3 при 400-450 °С сублимируется с разложением,
при 800-850 °С испаряется без разложения, выше 1000 °С диссоциирует
на Re и С12;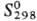 123,9
Дж/(моль·К); на воздухе при комнатной т-ре устойчив, в присут. влаги образует
дигидрат ReCl3-2H2O, при нагр. на воздухе или в среде
О2 дает оксохлориды и С12; получают термич. диссоциацией
ReCl5 или разложением хлорорената серебра. Среди важнейших кислородных
соединений Р.-рениевая к-та HReO4 (см. Рения оксиды
)и ее
соли-ренаты (VII), образующиеся при взаимод. HReO4 со щелочами, оксидами
или карбонатами металлов. Плохо раств. в воде ренаты Т1, К, Rb, Cs, Ag, умеренно-соли
NH4, Pb, хорошо-соли Na, Mg, Ca, Fe, Си и др.
123,9
Дж/(моль·К); на воздухе при комнатной т-ре устойчив, в присут. влаги образует
дигидрат ReCl3-2H2O, при нагр. на воздухе или в среде
О2 дает оксохлориды и С12; получают термич. диссоциацией
ReCl5 или разложением хлорорената серебра. Среди важнейших кислородных
соединений Р.-рениевая к-та HReO4 (см. Рения оксиды
)и ее
соли-ренаты (VII), образующиеся при взаимод. HReO4 со щелочами, оксидами
или карбонатами металлов. Плохо раств. в воде ренаты Т1, К, Rb, Cs, Ag, умеренно-соли
NH4, Pb, хорошо-соли Na, Mg, Ca, Fe, Си и др.
См. также Ренийорганические соединения
.
Получение. Осн. сырьевые
источники Р.-молибденитовые концентраты (содержание Р. 0.01-0,04%), медные концентраты
нек-рых месторождений (0,002-0,003% Р.), отходы от переработки медистых сланцев
(напр., свинцово-цинковые пыли, содержащие 0,04% Р.), а также сбросные воды
гидро-металлургич. переработки бедных молибденитовых концентратов (10-50 мг/л
Р.). При окислит. обжиге молибденитовых концентратов при 550-650 °С Р. удаляется
на 50-95% с печными газами в виде Re2O7. Он концентрируется
в шла-мах в р-рах, образующихся при очистке пылеуловит. систем. Для извлечения
Р. из молибденитовых концентратов используют также гидрометаллургич. методы.
На разл. стадиях произ-ва черновой меди Р. также удаляется с отходящими газами.
Если печные газы направляются в произ-во H2SO4, Р. концентрируется
в промывной к-те электрофильтров. Для извлечения Р. из пылей и шламов применяют
выщелачивание слабой H2SO4 или водой с добавкой окислителя
(МnО2).
Из р-ров Р. извлекают в
осн. сорбционными (с применением слабо- и сильноосновных ионитов) и экстракционными
(экстрагенты-триалкиламин, трибутилфосфат и др.) методами. В результате десорбции
или реэкстракции р-рами NH3 образуется NH4ReO4,
восстановлением к-рого водородом получают порошок Р. Восстановление осуществляют
в две стадии: первую-при 300-350°С, вторую-при 700-800 °С. Порошки прессуют
в штабики, их спекают при 1200-1300 °С, а затем при 2700-2850 °С в токе
Н2. Спеченные штабики уплотняют ковкой или прокаткой на холоду с
промежут. отжигами. Для получения компактного Р. применяют также плавку в электроннолучевых
печах.
Определение. Качественно
Р. обнаруживают хим., физ.-хим. и физ. методами. Пары Re2O7
и все летучие соединения Р. окрашивают пламя в бледно-зеленый цвет. Для качеств.
обнаружения используют микрохим. р-ции с метиленовым голубым, ацетатом бруцина,
нитратом стрихнина, ацетатом нитрона, хлоридом трипафлавина, солями К, Rb, Cs,
Tl, Ag и др.; предел обнаружения 0,10-0,25 мг Р. Количественно Р. определяют
гравиметрии., титриметрич., электрохим., спект-рофотометрич. (до 10-2-10-5%
по массе), спектральными (до 10-4-10-5% по массе), флуоресцентными,
рентгено-спектралъным (до 5·10-8%), радиоактивационными (особенно
нейтронно-активационным), масс-спектрометрич. (10-7%) и др. методами.
Гравиметрич. способы основаны на осаждении ренатов (VII) нитрона и тетрафениларсония,
а также Re2S7. Среди титриметрич. методов используют алка-лиметрич.
титрование HReO4, окислит:-восстановит. и комплексонометрич. титрование.
Спектрофотометрич. методы основаны на образовании в кислых р-рах окрашенных
соед. Re(V) и Re(IV). В щелочных р-рах Р. определяют по светопоглощению ренатов
(VII) щелочных металлов и тетрафениларсония.
Применение. Ок. 65% производимого
в мире Р. идет на получение Pt-Re катализаторов для нефтеперерабатывающей пром-сти
(получение бензина с высоким октановым числом). Р.-компонент жаропрочных сплавов
на основе W - Мо, а также сплавов на основе Ni, Cr, Mo, Ti; материал для электрич.
контактов, покрытий, термопар (Pt-Re, Mo-Re, W-Re), рентгеновских трубок, вакуумных
ламп, ламп-вспышек, измерит. аппаратуры; перспективный конструкц. материал для
атомных реакторов, использующих Na в качестве теплоносителя. На р-ции b-распада
187Re основан рений-осмиевый метод определения возраста горных пород
и метеоритов. Искусственно полученные изотопы 18*Re (T1/2
50 сут), 186Re (T1/2 88,9 ч) и 188Re
(T1/2 16,7 ч)-изотопные индикаторы.
Растворимые соединения
Р. мало токсичны. Пыль металлического Р. не вызывает интоксикации, а при введении
через органы дыхания приводит к слабо текущему фиброзу.
Мировое произ-во Р. (без
СНГ) ок. 15 т (1989), в т.ч. в Чили ок. 4,5 т (ведущий производитель Р.).
Р. открыли в 1925 В. Ноддак
и И. Такке.
Лит.: Борисова Л.
В., Ермаков А. Н., Аналитическая химия рения, М., 1974; Рений. Химия, технология,
анализ. Труды IV Всесоюзного совещания по проблеме рения, М., 1976; Раков Э.Г.,
Дудин А. С., Опаловский А. А., "Успехи химии", 1980, т. 49, в. 10,
с. 1945-62; Ряшенцева М.А., Миначев X. М., Рений и его соединения в гетерогенном
катализе, М., 1983; Сперанская Е. Ф., Электрохимия рения, А.-А., 1990; "Цветные
металлы", 1991, № 7, с. 32-51; "Bulletin bureau mines US department
of commerce", 1980, V. 671, p. 753-61; Kemmit R. D. W., Peacock R. D.,
The chemistry of manganese, technetium and rhenium, Oxf, 1975. Э.Г. Раков,
И. Д. Трошкина.
|

