АЛЬДОЛЬНАЯ КОНДЕНСАЦИЯ
, взаимод. двух молекул альдегида или кетона
(одинаковых или разных) в присут. к-т или оснований с образованием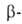 гидроксиальдегидов
(альдолей), напр.:
гидроксиальдегидов
(альдолей), напр.:
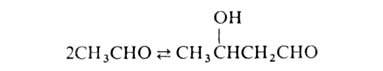
Р-ция обратима и может осуществляться только при наличии хотя бы у одного
реагента атома Н в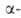 положении
к карбонильной группе. Кетоны реагируют значительно труднее альдегидов.
положении
к карбонильной группе. Кетоны реагируют значительно труднее альдегидов.
Щелочной катализ А.к. включает стадию образования сильного нуклеофила-енолят-аниона
и осуществляется по след. схеме (В- -основание):

А.к. двух разл. альдегидов или кетонов наз. перекрестной. При этом возможно
образование смеси разл. альдолей, напр.:
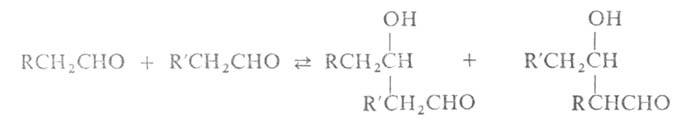
Р-ция региоселективна, если одно из двух соед., к-рое берут в избытке,
не содержит атома Н в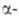 положении
к карбонильной группе. Если молекула енолята имеет объемные заместители
и процесс проводят при низких т-рах, А. к. характеризуется высокой стереоселективностью.
Так, при взаимод. трет
-бутилэтилкетона последовательно с диизопропиламидом
Li и бензальдегидом образуется альдоль эритро-РhСН(ОН)СН(СН3)С(О)С(СН3)з
(выход 100%), а при использовании вместо трет
-бутилэтилкетона мезитилэтилкетона-трео
-РhСН(ОН)СН(СН3)С(О)С6Н2(СН3)з
(выход 92%).
положении
к карбонильной группе. Если молекула енолята имеет объемные заместители
и процесс проводят при низких т-рах, А. к. характеризуется высокой стереоселективностью.
Так, при взаимод. трет
-бутилэтилкетона последовательно с диизопропиламидом
Li и бензальдегидом образуется альдоль эритро-РhСН(ОН)СН(СН3)С(О)С(СН3)з
(выход 100%), а при использовании вместо трет
-бутилэтилкетона мезитилэтилкетона-трео
-РhСН(ОН)СН(СН3)С(О)С6Н2(СН3)з
(выход 92%).
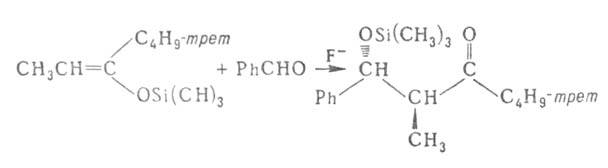
Для получения альдолей, особенно при применении ароматич. альдегидов,
широко используют р-цию триметилсилиловых эфиров енолов с карбонильными
соед. в присут. катализатора, напр. TiCl4, F-:
Побочные р-ции при А.к.-отщепление от альдоля, особенно при кислотном
катализе, одной молекулы Н2О с образованием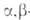 -ненасыщенного
карбонильного соед. (кротоновая конденсация
)и вовлечение самого
альдоля в конденсацию с др. карбонильными соединениями.
-ненасыщенного
карбонильного соед. (кротоновая конденсация
)и вовлечение самого
альдоля в конденсацию с др. карбонильными соединениями.
А. к. используется для пром. получения бутанола, 2-этилгексанола и пентаэритрита,
а также в препаративном синтезе прир. соединений. См. также Бутлерова реакция
.
Р-ция открыта Ш. Вюрцем в 1872.
Лит.: Общая органическая химия, пер. с англ., т. 2, М., 1982,
с. 600-602, 723-28; NielsenA.T., Ноulihan W.J., The aldol condensation,
N.Y., 1968 (Organic reactions, v. 16). Н.В.Лукашев.

