СЕРОВОДОРОД
Н2S,
мод. м. 34,082; бесцв. газ с резким запахом тухлых яиц; молекула Н2
S имеет угловую форму, длина связи S —H 0,1336 нм, угол HSH 92,06°,
m 0,34·10-29 Кл·м; плотн. 1,538 г/л (25 °С); 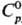 34,23 Дж/(моль·К);
34,23 Дж/(моль·К); 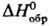 -20,50 кДж/моль;
-20,50 кДж/моль; 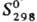 205,68 Дж/(моль·К); энергия диссоциации 724,0 кДж/моль; tкрит
100,4°С, ркрит 9,01 МПа, dкрит 0,349
г/см3. Легко сжижается в бесцв. жидкость, напр. при 0°С и давлении
1,02 МПа; для жидкого H2S: т. кип. - 60,35 °С, плотн. 0,938 г/см3
(-81 °С), 0,964 г/см3 (- 60 °С),
205,68 Дж/(моль·К); энергия диссоциации 724,0 кДж/моль; tкрит
100,4°С, ркрит 9,01 МПа, dкрит 0,349
г/см3. Легко сжижается в бесцв. жидкость, напр. при 0°С и давлении
1,02 МПа; для жидкого H2S: т. кип. - 60,35 °С, плотн. 0,938 г/см3
(-81 °С), 0,964 г/см3 (- 60 °С), 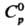 68,0 Дж/(моль · К) (200 К), ур-ние температурной зависимости давления пара lgp(MM
рт. ст.) = — 1538,5/T+ + 26,826 + 9,08lgT- 6,448T (195
68,0 Дж/(моль · К) (200 К), ур-ние температурной зависимости давления пара lgp(MM
рт. ст.) = — 1538,5/T+ + 26,826 + 9,08lgT- 6,448T (195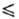 Т
Т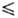 350
К),
350
К), 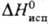 18,7 кДж/моль
(- 60,35 °С); e 8,04.
18,7 кДж/моль
(- 60,35 °С); e 8,04.
С. затвердевает в бесцв.
кристаллы кубич. сингонии, при - 146,95 °С претерпевает фазовый переход
второго рода (при -169,5°С а = 0,580 нм, z = 4, пространств.
группа Ра3), ниже —169,65 °С переходит в тетрагон. форму,
DH перехода 1,53 кДж/моль; т. пл. — 85,7 °С, плотн. твердого
H2S 1,217 г/см3 (-195 °С), 1,12 г/см3 (-
86 °С); 2,38
кДж/моль; ур-ния температурной зависимости давления пара lgp(мм рт. ст.)
= - 1080,6/Г+ 7,880 (163
2,38
кДж/моль; ур-ния температурной зависимости давления пара lgp(мм рт. ст.)
= - 1080,6/Г+ 7,880 (163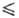 Т
Т 188
К), lgp(мм рт. ст.) = - 1175,3/74 8,501 (128
188
К), lgp(мм рт. ст.) = - 1175,3/74 8,501 (128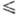 Г
Г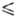 142
К).
142
К).
При обычной т-ре С. устойчив,
в вакууме начинает диссоциировать выше 500 °С, при ~ 1690°С полностью
разлагается. Р-римость газообразного H2S в воде (% по массе, 0,1
МПа): 0,694 (0°С), 0,378 (20 °С), 0,232 (40 °С), 0,076 (80 °С);
или 4,37 (О °С) и 2,91 (20 °С) объемов Н2 S на 1 объем воды.
Водный р-р С.-сероводородная к-та-слабая к-та (K1 =
9,5·10-8, K2 = 1·10-14), образующая соли-сульфиды
и гидросульфиды (см. Сульфиды неорганические
). Известен клатрат
Н2S · 6Н2О. Лучше, чем в воде, С. раств. в орг. р-рителях;
напр., в одном объеме этанола раств. 17,89 (0°С) и 7,42 (20 °С) объемов
H2S.
Электролитич. диссоциация
жидкого Н, S (2H2S 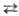 H3S+ + SH- ) ничтожно мала (К = 3· 10-33);
жидкий С. смешивается с СС14 во всех соотношениях, растворяет мн.
углеводороды; также раств. AsCl3, РС15, SbCl3
и др. хлориды неметаллов, подвергая их сольволизу, не раств. типичные соли-NaCl
и т.п.
H3S+ + SH- ) ничтожно мала (К = 3· 10-33);
жидкий С. смешивается с СС14 во всех соотношениях, растворяет мн.
углеводороды; также раств. AsCl3, РС15, SbCl3
и др. хлориды неметаллов, подвергая их сольволизу, не раств. типичные соли-NaCl
и т.п.
С.-сильный восстановитель.
При натр. на воздухе постепенно окисляется, при ~ 250 °С воспламеняется.
Горит, при избытке О2 образует SO2 и воду, при недостатке-S
и воду (пром. способ получения S). С. легко окисляется в водном р-ре кислородом,
галогенами; на восстановлении I2 до HI в р-ре основано определение
H2S методом иодометрии. Сильные окислители (HNO3, Cl2)
окисляют С. до Н2SO4. С. взаимод. с большинством металлов
и их оксидов при натр. в присут. влаги и воздуха с образованием сульфидов металлов.
С олефииами, спиртами, хлорароматич. соединениями, эпоксидами дает тиолы, с
нитрилами -тиоамиды. Др. соед. S с водородом -сульфоны
H2Sx.
В природе H2S
встречается гл. обр. в месторождениях нефти и прир. газа, а также в вулканич.
газах и водах минер. источников; он растворен в глубоких (ниже 150-200 м) слоях
воды Черного моря (концентрация С. у дна достигает 11-14 мл/л). С. постоянно
образуется в природе при разложении белковых в-в.
В пром-сти С. получают
как побочный продукт при очистке нефти, прир. и пром. газов. Осн. методы очистки
этих газов с получением С.-моноэтаноламиновый, вакуум-карбонатный, содовый.
Принципиальная схема выделения С. из прир. и пром. газов заключается в следующем:
газ вводится в ниж. часть абсорбера, к-рый сверху орошается р-ром абсорбента,
затем насыщенный H2S р-р поступает в отгонную колонну, где при нагр.
горячим паром происходит десорбция С. из р-ра. В лаборатории С. получают действием
Н2 SO4 на FeS; м. б. получен из Н2 и паров
S при 500-600 °С в присут. катализатора (пемза); удобный метод получения
H2S-нагревание серы с парафином.
С. применяют в осн. для
произ-ва S и H2SO4. Его используют также для получения
разл. сульфидов (в частности, сульфидов и гидросульфидов Na, NH4
), сераорг. соед. (тиофены, тиолы и т. п.), тяжелой воды, для приготовления
лечебных сероводородных ванн, в аналит. химии для осаждения сульфидов металлов.
H2S м. б. рабочим в-вом мол. газовых лазеров. Взрывоопасен, КПВ в
воздухе 4,5-45,5% по объему.
С. токсичен, поражает слизистые
оболочки, дыхат. органы, ПДК в воздухе рабочей зоны 10 мг/м3, в атм.
воздухе 0,008 мг/м3. При концентрации С., напр. 6 мг/м3,
уже через 4 ч появляются головные боли, слезотечение. С. отравляет окружающую
среду. Он содержится в горючих газах (прир. нефтепереработки, генераторный,
коксовый) и отходящих газах (в произ-ве вискозы, хвостовые газы в произ-ве S).
О методах очистки пром. газов от С. см. Газов очистка
.
И. Н. Один.
|

