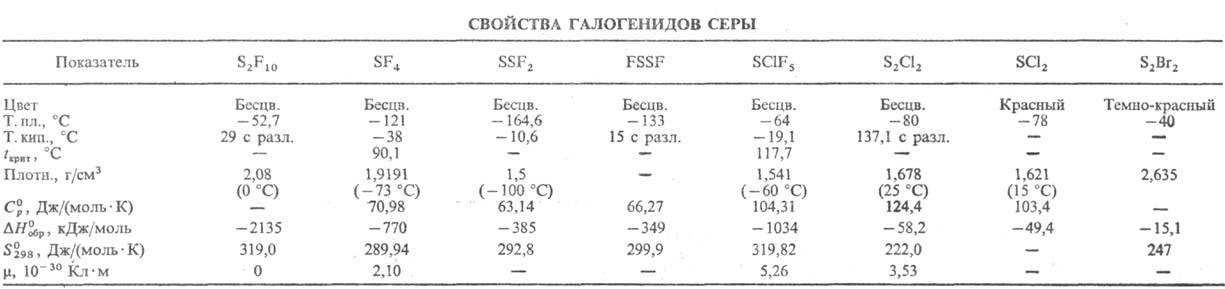
СЕРЫ ДИОКСИД
(сернистый
газ, сернистый ангидрид) SO2, мол. м. 64,066; бесцв. газ с резким
запахом; молекула имеет угловую форму, длина связи S—О 0,1432 нм, угол OSO 119,04°,
m 0,54·10-29 Кл·м; т. пл. -75,46°С, т.кип. -10,6 °С.
Для газа: плотн. 2,92655 г/л, С0р 39,8 Дж/(моль
· К), 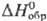 -296,81
кДж/моль,
-296,81
кДж/моль, 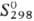 248,11
Дж/(.Дмоль·К); tкрит 157,5°С,
ркрит 7,88 МПа, dкрит 0,524 г/см3.
Легко сжижается в бесцв. легкоподвижную жидкость, напр. при 25 °С и давлении
ок. 0,5 МПа. Для жидкого: плотн. 1,4619 г/см3 (— 10°С),
248,11
Дж/(.Дмоль·К); tкрит 157,5°С,
ркрит 7,88 МПа, dкрит 0,524 г/см3.
Легко сжижается в бесцв. легкоподвижную жидкость, напр. при 25 °С и давлении
ок. 0,5 МПа. Для жидкого: плотн. 1,4619 г/см3 (— 10°С), 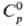 20,8 Дж/(моль·К) в интервале 273-313 К (под давлением SO2),
20,8 Дж/(моль·К) в интервале 273-313 К (под давлением SO2), 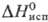 24,92 кДж/моль (263 К); давление пара над жидким
SO2 0,84 МПа (50 °С), 0,325 МПа (20 °С), 0,1 (-10,06 °С);
DHисп 24,90 кДж/моль (263,09 К); e 13,8. Твердый
С.д.-бесцв. кристаллы ромбич. сингонии; ур-ние температурной зависимости давления
пара над твердым SO2 lgp (мм рт. ст.) = - 1850/74 10,45 (161,6
24,92 кДж/моль (263 К); давление пара над жидким
SO2 0,84 МПа (50 °С), 0,325 МПа (20 °С), 0,1 (-10,06 °С);
DHисп 24,90 кДж/моль (263,09 К); e 13,8. Твердый
С.д.-бесцв. кристаллы ромбич. сингонии; ур-ние температурной зависимости давления
пара над твердым SO2 lgp (мм рт. ст.) = - 1850/74 10,45 (161,6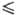 Т
Т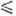 197,2
К).
197,2
К).
С. д. заметно диссоциирует
лишь ок. 2800 °С. Собств. диссоциация жидкого С. д. происходит по схеме:
2SO2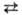 SO2+ +
SO2+ +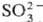 .
Р-римость в воде (г в 100 г): 22,8 (О °С), 11,5 (20
°С), 2,1 (90 °С). Водный р-р SO2-сернистая к-та H2SO3:
сильная двухосновная к-та (при 18°С К1 1,54·10-2,
pKa1 1,81, К2
1,02·10-7, pKa2 6,91), существующая
только в р-ре. Соли Н2SО3-сульфиты и гидросульфиты (см. Сульфиты неорганические
). Получен гидрат клатрат-ного типа SO2·7H2O.
.
Р-римость в воде (г в 100 г): 22,8 (О °С), 11,5 (20
°С), 2,1 (90 °С). Водный р-р SO2-сернистая к-та H2SO3:
сильная двухосновная к-та (при 18°С К1 1,54·10-2,
pKa1 1,81, К2
1,02·10-7, pKa2 6,91), существующая
только в р-ре. Соли Н2SО3-сульфиты и гидросульфиты (см. Сульфиты неорганические
). Получен гидрат клатрат-ного типа SO2·7H2O.
С. д. раств. также в этаноле,
H2SO4, олеуме, СН3СООН. Жидкий SO2
смешивается в любых соотношениях с SO3, СНСl3, CS2,
даэтиловым эфиром, растворяет хлориды -РСl5, AsCl3 и мн.
др., SOCl2, Вr2, I2, иодиды и роданида металлов,
не раств. S. Растворенные в жидком SO2 соли диссоциируют.
С. д. может восстанавливаться
до S и производных S(II) и окисляться - до соед. S(VI). Сильные окислители-О3,
Н2О2, HNO3, оксиды азота, р-ры хлоратов, перманганатов,
хроматов окисляют SO2 до H2SO4 и ее солей.
Кислород окисляет SO2 при ~ 440 °С в присут. катализатора (V2O5)
до SO3; эта р-ция лежит в основе пром. способа получения SO3
и затем Н2 SO4. При высоких т-рах в присут. катализатора
SO2 восстанавливается водородом до H2S, CO-до S с частичным
образованием также COS, CS2. В водном р-ре, содержащем H2S
и SO2 (т. наз. жидкость Вакенро-дера), происходят сложные превращения,
ведущие к образованию S и политионовых к-т (см. Политионаты
). С
С12 С. д. дает SO2Cl2 (см. Сулъфурилгалогениды).
С газообразным NH3
С. Д. образует амидосульфиновую HSO2NH2 и имидодисульфиновую
HSO2NHSO2H к-ты, а с NH3 в присут. паров воды-(NН4)2SО3
и NH4HSO3; аналогично происходят р-ции с орг. аминами.
С алканами С. д. в присут. О2 или Сl2 вступает в р-ции
соотв. сульфо-окисления или сульфохлорирования:
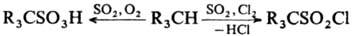
С олефинами С. д. образует
сополимеры.
С. д. получают сжиганием
серы, а также как побочный продукт обжига медных и цинковых сульфидных руд.
Осн. пром. способ получения SО2-из железного колчедана FeS2.
Горячий обжиговый газ, полученный при сжигании FeS2 (4FeS2
+ 11O2 : 2Fe2O3 + 8SO2),
после отделения пыли обрабатывают слабой холодной H2SO4;
при этом примеси (As2O3, SeO2 и др.) образуют
туман, их отделяют в Электрофильтрах; затем С. д. сушат. Кроме того, С. д. с
концентрацией до 50% по объему получают при Действии на алунит K2SO4(A12SO4)3·2A12O3
паров орг. восстановителя, содержащего непредельные углеводороды; для получения
100%-ного SO2 в этом и др. случаях в пром-сти используют поглотители-водные
р-ры (NH4)2SO3-NH4HSO3.
После поглощения SO2 из отходящих газов р-р нагревают до кипения,
выделяющийся влажный С. д. охлаждают, конденсируют влагу и высушивают. В лаборатории
С. д. получают р-цией конц. Н2 SO4 с Na2SO3
или NaHSO3 или при нагр. конц. Н2SO4 с Сu.
Осн. область применения
SО2-произ-во SO3 и H2SO4. Его используют
также в произ-ве сульфитов, гидросульфитов, тиосульфатов, сульфурилхлорида и
др. соединений S. С. д. обесцвечивает мн. орг. красители, что используется при
отбеливании шерсти, шелка, соломы и т. п. С. д. применяют для консервирования
фруктов, ягод и как дезинфицирующее ср-во. Жидкий С.д.-хладагент в холодильной
технике, р-ритель. С. д. используют в аналит. химии, он м. б. рабочим в-вом
в газовых лазерах.
С. д. токсичен. При концентрации
0,03-0,05 мг/л раздражает слизистые оболочки, дыхат. органы, глаза.
ПДК в воздухе производств.
помещений 10,0 мг/м3, в атм. воздухе 0,5 мг/м3. С.д.-один
из осн. ядов, отравляющих окружающую среду. Он вызывает образование кислотных
дождей, вредно действует на живые организмы (см. Охрана природы
).
Содержится в дымовых газах, образующихся при сжигании сернистых тошшв, в
отходящих газах переработки серосодержащего сырья, выбросах металлургич. произ-в
(см. Металлургия
). Об очистке пром. газов от SO2 см. Газов очистка
. Хранят и транспортируют в баллонах серого цвета. и. н. один.
|

