СОЛИ
, класс хим.
соединений. Общепринятого определения понятия "С.", так же как и
терминов "кислоты и основания", продуктами взаимод. к-рых С. являются,
в настоящее время не существует. С. могут рассматриваться как продукты замещения
протонов водорода к-ты на ионы металлов,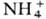 ,
,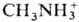 и др. катионы или групп ОН основания
на анионы к-т (напр., Сl-,
и др. катионы или групп ОН основания
на анионы к-т (напр., Сl-,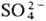 ).
Продуктами полного
замещения являются средние С., напр. Na2SO4, MgCl2,
неполного - кислые или основные С., напр. KHSO4, CuClOH. Различают
также простые С., включающие один вид катионов и один вид анионов (напр., NaCl),
двойные С., содержащие два вида катионов [напр., KAl(SO4)2·12H2O],
смешанные С., в составе к-рых два вида кислотных остатков (напр., AgClBr). Комплексные
С. (см. Координационные соединения
)содержат комплексные ионы, напр.
K4[Fe(CN)6]. Т. наз. внутренние С, напр. бетаин
(CH3)3NCH2COO-, представляют
собой биполярные ионы.
).
Продуктами полного
замещения являются средние С., напр. Na2SO4, MgCl2,
неполного - кислые или основные С., напр. KHSO4, CuClOH. Различают
также простые С., включающие один вид катионов и один вид анионов (напр., NaCl),
двойные С., содержащие два вида катионов [напр., KAl(SO4)2·12H2O],
смешанные С., в составе к-рых два вида кислотных остатков (напр., AgClBr). Комплексные
С. (см. Координационные соединения
)содержат комплексные ионы, напр.
K4[Fe(CN)6]. Т. наз. внутренние С, напр. бетаин
(CH3)3NCH2COO-, представляют
собой биполярные ионы.
Типичные С. -кристаллич.
в-ва с ионной структурой, напр. CsF (см. Ионная связь, Ионные кристаллы
).
Существуют также ковалентные С., напр. А1Сl3 (см. Ковалентные кристаллы
). В действительности характер хим. связи у многих С. -
смешанный. О правилах образования названий С. см. Номенклатура химическая
.
По р-римости в воде различают
растворимые, мало растворимые и практически нерастворимые С. К р-римым относятся
почти все С. натрия, калия и аммония, мн. нитраты, ацетаты и хлориды, за исключением
солей поливалентных металлов, гидролизующихся в воде, мн. кислые С.
В водных р-рах С. полностью
или частично диссоциируют на ионы (см. Электролитическая диссоциация
). С.
слабых к-т и(или) слабых оснований подвергаются при этом гидролизу. Водные р-ры
С. содержат гидратир. ионы (см. Гидратация
), ионные пары и более
сложные хим. формы, включающие продукты гидролиза и др. Ряд С. раств. также
в спиртах, ацетоне, амидах к-т и др. орг. р-рителях.
Из водных р-ров С. могут
кристаллизоваться в виде кристаллогидратов (см. Гидраты
), из неводных-в
виде кристаллосольватов, напр. СаВr2·3С2Н5ОН
(см. Сольваты
). Р-ры С. взаимод. с металлами, стандартные электродные
потенциалы к-рых более отрицательны, чем потенциал металла, входящего в состав
С.:
Zn + Hg(NO3)2(p_p)
: Zn(NO3)2(p-p) + Hg
Из хорошо р-римых С. слабых
к-т более сильные к-ты вытесняют более слабые:
CH3COONa + HCl(p-p) : CH3COOH + NaCl
Из хорошо р-римых С. слабых
оснований более сильные р-римые основания вытесняют более слабые:
АlСl3(р_р)
+ 3NаОН(p-р) : А1(ОН)3 + 3NaCl(p-p)
В водно-солевых системах
между С. могут протекать обменные р-ции, процессы образования труднорастворимых
или комплексных С.:
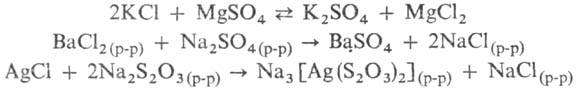
Данные о разл. процессах,
протекающих в водно-солевых системах, о р-римости солей при их совместном присутствии
в зависимости от т-ры, давления и концентрации, о составе твердых и жидких фаз
м. б. получены при изучении диаграмм р-римости водно-солевых систем (рис. 1,
2; см. также Растворы
, Физико-химический анализ
).
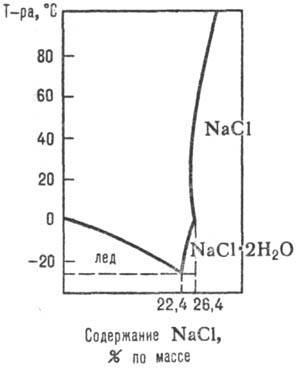
Рис. 1. Диаграмма р-римости
системы NaCl-H2O.
Общие способы синтеза С.
Взаимод. к-т и оснований (р-ция нейтрализации, ур-ние 1), а также к-т с основными
оксидами (2) и оснований с кислотными оксидами (3) или кислотных и основных
оксидов (4):
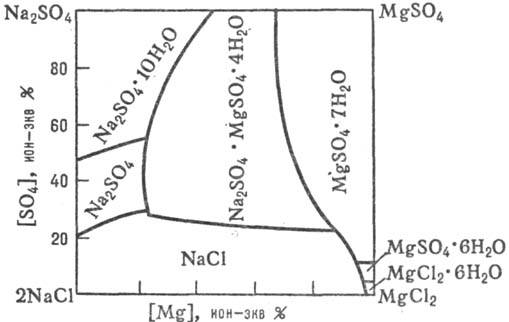
Рис. 2. Диаграмма р-римости
"морской" системы 2NaCl + MgSO4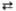
 MgCl2
+ Na2SO4 в воде при 25 °С.
MgCl2
+ Na2SO4 в воде при 25 °С.
Следует отметить, что продукты
взаимод. оснований и к-т Льюиса (см. Кислоты и основания
) отличаются
от обычных С. и по отношению к ним применяют назв. "кислотно-основной
комплекс" или "аддукт". Обменное
взаимод. между к-той и солью или основанием и солью (5,6):
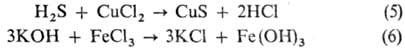
Взаимод. двух разл. солей
(7), металлов с к-тами (8), металлов с неметаллами (9), металлов с солями (10):
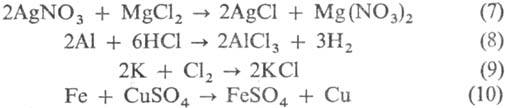
Сырьем для пром. получения
ряда С.-хлоридов, сульфатов, карбонатов, боратов Na, К, Са, Mg служат морская
и океанич. вода, прир. рассолы, образующиеся при ее испарении, и твердые залежи
солей (см. Галургия
). Для группы минералов, образующих осадочные солевые
месторождения (сульфатов и хлоридов Na, К и Mg), применяют условное назв. "природные
соли". Наиб. крупные месторождения калиевых С. находятся в России (Соликамск),
Канаде и ФРГ, мощные залежи фосфатных руд-в Северной Африке, России и Казахстане,
NaNO3-B Чили.
С. используют в пищ., хим.,
металлургич., стекольной, кожевенной, текстильной пром-сти, в с. х-ве, медицине
и т. д.
См. также Бораты неорганические
,
Галогениды
, Карбонаты неорганические
, Нитраты неорганические
, Сульфаты неорганические
,
Фосфаты неорганические
и др.
Лит.: Позин
М. E., Технология минеральных солей, 4 изд., ч. 1 -2, Л., 1974; Бацанов
С. С., Экспериментальные основы структурной химии, М., 1986, с. 195-226; Ксензенко
В. И., Кононова Г. Н., Теоретические основы про-дессов переработки галургического
сырья, М., 1982, с. 11-211. В. П. Данилов.
|

