АМИЛАЗЫ
(от лат. amylum - крахмал), ферменты класса гидролаз,
катализирующие гидролиз крахмала, гликогена и др. родственных олиго- и
полисахаридов, гл. обр. по 1,4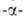 глюкозидной
связи (см., напр., схему в ст. О-Гликозидгидролазы).
глюкозидной
связи (см., напр., схему в ст. О-Гликозидгидролазы).
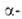 А. (мол.
м. 50 тыс.) участвует в гидролизе Сахаров, содержащих подряд три или более
остатков глюкозы. Расщепление связей может происходить между любыми остатками
глюкозы, причем остатки моносахаридов в месте разрыва имеют конфигурацию
А. (мол.
м. 50 тыс.) участвует в гидролизе Сахаров, содержащих подряд три или более
остатков глюкозы. Расщепление связей может происходить между любыми остатками
глюкозы, причем остатки моносахаридов в месте разрыва имеют конфигурацию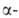 аномеров.
аномеров.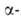 А.
превращает амилозу крахмала в глюкозу и мальтозу. Находящийся в крахмале
амилопектин, содержащий в молекуле 1,6
А.
превращает амилозу крахмала в глюкозу и мальтозу. Находящийся в крахмале
амилопектин, содержащий в молекуле 1,6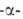 связи, полностью не гидролизуется - остается разветвленный полисахарид,
т. наз. "остаточный декстрин".
связи, полностью не гидролизуется - остается разветвленный полисахарид,
т. наз. "остаточный декстрин". А.
обладает
слабокислыми св-вами. Ионы Са2+ и Cl- активируют
ее. Присутствует во всех тканях животных и растений, а также в микроорганизмах.
По каталитич. активности ферменты из разных источников значительно отличаются
друг от друга.
А.
обладает
слабокислыми св-вами. Ионы Са2+ и Cl- активируют
ее. Присутствует во всех тканях животных и растений, а также в микроорганизмах.
По каталитич. активности ферменты из разных источников значительно отличаются
друг от друга. А.
слюны, поджелудочной железы и слизистой кишечника участвуют в переваривании
пищи,
А.
слюны, поджелудочной железы и слизистой кишечника участвуют в переваривании
пищи, А.
печени расщепляет гликоген.
А.
печени расщепляет гликоген.
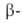 А. (мол.
м. 50-200 тыс.) последовательно отщепляет остатки
А. (мол.
м. 50-200 тыс.) последовательно отщепляет остатки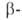 мальтозы
от невосстанавливающего конца цепи полисахаридов. Под действием
мальтозы
от невосстанавливающего конца цепи полисахаридов. Под действием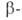 А.
из амилозы образуется мальтоза, а из амилопектина также "остаточный декстрин".
Содержится
А.
из амилозы образуется мальтоза, а из амилопектина также "остаточный декстрин".
Содержится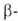 А.
в солоде.
А.
в солоде.
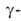 А. (экзо-1,4
А. (экзо-1,4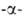 глюкозидаза;
мол. м. 50-100 тыс.) последовательно отщепляет концевые остатки
глюкозидаза;
мол. м. 50-100 тыс.) последовательно отщепляет концевые остатки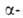 D-глюкозы
от невосстанавливающих концов цепей полисахаридов с образованием
D-глюкозы
от невосстанавливающих концов цепей полисахаридов с образованием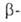 D-глюкозы.
Способна также расщеплять 1,6
D-глюкозы.
Способна также расщеплять 1,6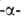 связь, если следующие за ней моносахариды соединены в положениях 1 и 4.
Содержится в плесневых грибах. Определение активности А. используют в диагностич.
целях, в частности для идентификации гликогеноза. А. (в т. ч. иммобилизованные)
применяют в пром-сти:
связь, если следующие за ней моносахариды соединены в положениях 1 и 4.
Содержится в плесневых грибах. Определение активности А. используют в диагностич.
целях, в частности для идентификации гликогеноза. А. (в т. ч. иммобилизованные)
применяют в пром-сти: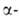 А.-для
"осахаривания" крахмала,
А.-для
"осахаривания" крахмала,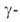 А.-для
произ-ва глюкозы.
А.-для
произ-ва глюкозы.
Лит.. МасAllister R. V., "Advances in Enzyme Regulation", 1964,
v. 3, p. 15-46; The enzymes, 3 ed., v. 5, N. Y.-L., 1971, p. 115-89; Mechanisms
of sacharide polymerization and depolymerization, N. Y [a.o.] 1980, p.
73-100, 209-14. В. И. Муронец.

