СТРОНЦИЯ КАРБОНАТ
SrСО3, бесцв. кристаллы; до 925 °С существует a-модификация
с ромбич. кристаллич. решеткой типа арагонита (а = 0.5107 нм, b -
0,8414 нм, с = 0,6029 нм, пространств. группа Ртсп, плота.
3,785 г/см3); выше 925 °С стабильна гексагон. b-модификация
структурного типа кальцита (пространств. группа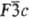 );
при 1416 °С и давлении СО2 2 МПа образуется g-модификация
предположительно кубич. сингонии; т. пл. 1494 °С;
);
при 1416 °С и давлении СО2 2 МПа образуется g-модификация
предположительно кубич. сингонии; т. пл. 1494 °С;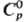 82,42 Дж/(моль·К);
82,42 Дж/(моль·К); 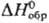 -1227,0 кДж/моль, DH перехода a:b 16,7 кДж/моль,
DHпл 40 кДж/моль;
-1227,0 кДж/моль, DH перехода a:b 16,7 кДж/моль,
DHпл 40 кДж/моль;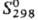 97,2 Дж/(моль·К).
97,2 Дж/(моль·К).
С. к. при нагр. разлагается
на SrO и СО2, ур-ние температурной зависимости давления диссоциации:
lgpCO2(Па) = = 12,767-11549/T (1093-1193К), lgpCO2(Пa)
=11,942--10579/T (1203-1323К). Мало раств. в воде (2·10-3г
в 100 г при 25 °С). При избытке СО2 в р-ре превращ. в гидрокарбонат
Sr(НСО3)2.
С. к. получают осаждением
Na2CO3 или (NH4)2CO3
из р-ра нитрата или сульфата Sr. В природе-минерал стронцианит. С. к. используют
в качестве одного из исходных компонентов при изготовлении оксидных катодов
электровакуумных приборов, высокотемпературных сверхпроводников,
нек-рых сортов стекол (в т. ч. для кинескопов цветных телевизоров), эмалей.,
глазурей. П. В. Ковтуненко, Я. Л. Хариф.
|

