СУЛЬФИДЫ НЕОРГАНИЧЕСКИЕ
,
соед. серы с металлами, а также с более электроположит. неметаллами. Бинарные
сульфиды (С.) могут рассматриваться как соли сероводородной к-ты H2S
(см. Сероводород
)-средние, напр. 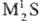
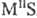
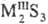 ,
и кислые, или гидросульфиды, MHS, M(HS)2. Существуют полисульфиды,
содержащие связи S—S, напр.:
,
и кислые, или гидросульфиды, MHS, M(HS)2. Существуют полисульфиды,
содержащие связи S—S, напр.: 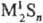 и,
и,
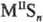 где n >
1,
где n >
1,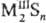 , где
n > 3.
, где
n > 3.
Известны также двойные
С., напр. фазы Шеврёля [Шевреля], Ag3AsS3, CuSbS2, нек-рые
из них используют как полупроводниковые материалы, оксисульфиды переходных металлов
MOS и M2O2S, сульфидогалогениды, напр. SbSI (сегнетоэлектрик).
По типу хим. связи С. можно
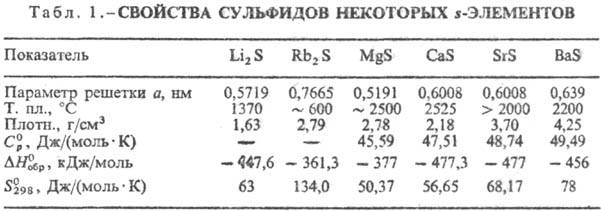
разделить на три осн. группы. К первой относят С. s-элементов-щелочных
и щел.-зем. металлов, Mg, для к-рых характерна ионно-кова-лентная связь с нек-рым
преобладанием ионной составляющей. M2S кристаллизуются в структуре
типа антифлюорита, МIIS-в структурах типа NaCl с высокими координац.
числами для S(6, 8).
Эти С. имеют относительно высокие DHобр, т-ры плавления
(табл. 1), солеподобны, бесцветны, гигроскопичны. Многие из них раств. в воде
с разложением (С. щелочных металлов, BaS), образуют кристаллогидраты. Окисляются
кислородом воздуха, Н2О2 и др. до сульфатов, легко разлагаются
НС1, HNO3 и H2SO4 на холоду. Полисульфиды химически
менее стойки, чем простые С., причем их устойчивость уменьшается с повышением
содержания в них S. При нагр. легко разлагаются на S и простые С.
Ко второй группе относят
С. d-металлов и f-металлов с составами MS, M5S7,
M3S4, M2S3, MS2, MS3
и др. У низших С. хим. связь носит преим. металлич. характер, у высших-ионно-ковалентный.
Кристаллизуются в разл.
структурах, для соед. M2S3 характерен полиморфизм. В табл.
2 представлены С. с кубич. структурой - MS (типа NaCl, пространств. группа Fm3m,
z = 4) и M2S3 (типа Th3P4, пространств.
группа I43d, z = 4), а также с гексагон. MS2
(типа CdI2, пространств. группа 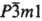 ,
z = 1). Термическая устойчивость С. этой группы
достаточно высока и снижается с увеличением содержания S. В воде не раств.,
разлагаются горячими конц. НСl и H2SO4, а также бромной
водой, царской водкой. Окисляются при нагревании на воздухе до оксидов и основных
сульфатов.
,
z = 1). Термическая устойчивость С. этой группы
достаточно высока и снижается с увеличением содержания S. В воде не раств.,
разлагаются горячими конц. НСl и H2SO4, а также бромной
водой, царской водкой. Окисляются при нагревании на воздухе до оксидов и основных
сульфатов.
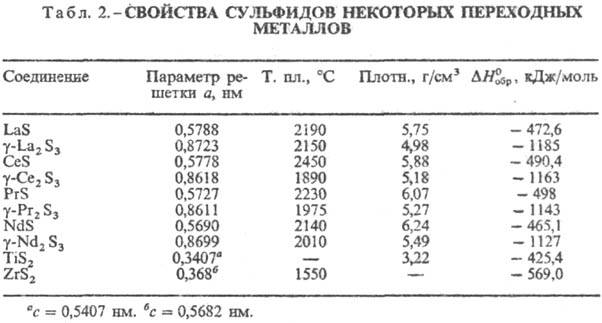
К третьей группе относят
С. p-элементов (табл. 3), а также близкие к ним сульфиды Zn, Cd, Hg,
Cu2S, Ag2S. Хим. связь в них ковалентно-ионная, причем
вклад ковалентной составляющей повышается с увеличением номера группы. Многие
из этих С. имеют сложные каркасные и слоистые кристаллич. структуры с невысоким
координац. числом для атома S., Как правило, эти С. химически нестойки, мн.
реагируют с влагой воздуха, легко раств. минер. к-тами, быстро окисляются при
нагр. на воздухе, в воде практически не растворяются.
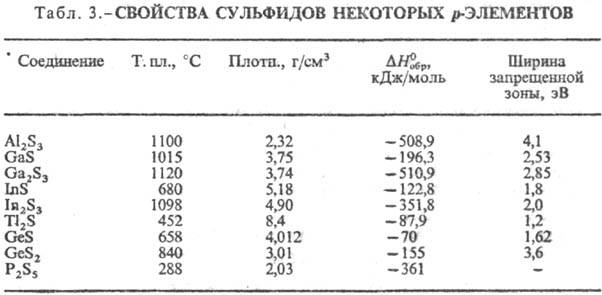
По физ. св-вам С. можно
разделить на след. группы: диэлектрики (С. щелочных, щел.-зем. металлов, Mg,
Al, Be); полупроводники (С. p-элементов, высшие С. d- и f-элементов,
Cu2S, Ag2S, ZnS, CdS, HgS); С. с металлич. проводимостью
(низшие С. d- и f-элементов MS); сверхпроводники (напр., La3S4
с критич. т-рой 8,25 К, фазы Шеврёля [Шевреля] МnМо6S8,
где M-Ag, Си и др.). Они м. б. диамагниты (С. s-
и р-элементов), парамагнитны
(низшие С. d- и f-элементов), антиферро-, ферри- и ферромагнитны
(напр., железа сульфиды
). Однако С. часто бывают нестехиометрич.
соединениями, иногда с широкими областями гомогенности, что оказывает влияние
на физ. св-ва С.
С. получают взаимод. простых
в-в в вакууме или инертной атмосфере, р-цией H2S с металлами, их
оксидами, гидроксидами или солями, восстановлением сульфатов углем, Н2,
прир. газом, термич. разложением высших С. или их восстановлением Н2.
Монокристаллы выращивают направленной кристаллизацией из расплава, осаждением
из паровой фазы, хим. транспортными р-циями, методом Фрерихса (взаимод. паров
металла с H2S), зонной плавкой. Пленки получают осаждением из паровой
фазы, методом мол.-лучевой эпитаксии, хим. осаждением из газовой фазы, осаждением
из водных р-ров.
Многие С. встречаются в
природе в виде минералов, напр. пирит (железный колчедан) FeS2, сфалерит
ZnS, халькопирит CuFeS2, галенит PbS, образуют полиметаллич. сульфидные
руды.
Природные С.-исходное сырье
для получения металлов, а также H2SO4 и сульфатов (FeS2).
С. используют в кожев. пром-сти для удаления волос со шкур (BaS, Na2S,
BaS2), как основу люминофоров и полупроводники, полисульфиды Са и
Ва-для борьбы с вредителями в с. х-ве, сульфиды Ва и Zn- компоненты литопона.
С, нек-рых РЗЭ перспективны как материалы для высокотемпературных термогенераторов,
как оптич., магн. и полупроводниковые материалы. См. также Натрия сульфиды
,
Свинца халькогениды
, Сурьмы халькогениды
, Цинка халькогениды
и др.
Лит.: Самсонов Г.
В., Дроздова С. В., Сульфиды, М., 1972.
И. Н. Один.
|

