СУЛЬФИДЫ ОРГАНИЧЕСКИЕ
(тиоэфиры), соед. общей ф-лы RSR, где R и R-opг. остатки; атом S может входить
в цикл.
Наиб. часто С. о. называют,
прибавляя суффикс "сульфид" к названию орг. радикалов, напр. СН3SС2Н5-метилэтил-сульфид,
(С1СН2)2S-бис-(хлорметил)сульфид. В полифунк-цион.
соединении группу RS называют органилтио-, напр. C2H5S(CH2)2COOH-3-(этилтио)пропионовая
к-та. Используют также заменительную номенклатуру, напр. СН3SСН2SСН3-2,4-дитиапентан.
Циклические Со. называют по правилам наименования гетероциклических соединений
.
Иногда употребляют систематич. и тривиальные назв. кислородсодержащих соед.
с префиксом "тио", напр. тиооксид этилена, тиоанизол и т.п. Особую
номенклатуру применяют в Chemical Abstracts, напр. (СН3)2S-тиобисме-тан,
Ph2S -1,1 -тиобензол.
В природе С. о. содержатся
в неочищенной нефти в качестве примесей, нек-рые С. о.-биологически активные
прир. соединения, напр. метионин.
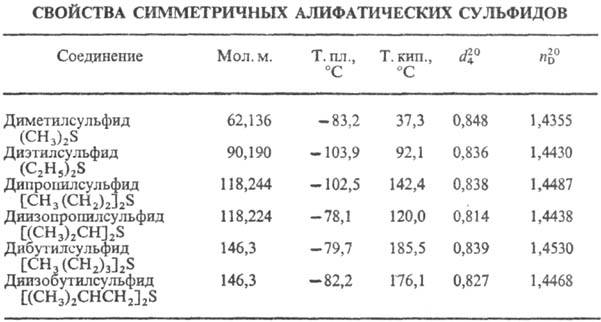
Низшие алифатические С.
о.-подвижные бесцв. жидкости; не раств. в воде, хорошо раств. в орг. р-рителях.
Технические С. о. обладают неприятным запахом, чистые-без запаха. С. о. кипят
выше своих кислородных аналогов-простых эфиров.
В ИК спектрах С. о. наблюдаются
валентные колебания связей R—S в области 570-705 см-1 (при R = Alk-слабые
полосы, при R = Ar, винил-полосы средней интенсивности). Фрагмент CH3S
дает характерную полосу поглощения при 1325 см-4 (деформац. колебания
связи С—Н). В УФ спектрах алифатических С. о. присутствуют полосы поглощения
200, 220 и 240 нм, для алкиларилсульфидов 205-230, 235-270, 275-300 нм, обусловленные
переходами n : s*.
Длина связи С—S ок. 0,18
нм для насыщ. алифатических С. о. и ок. 0,175 нм для диарилсульфидов. Валентный
угол между связями R—S—R возрастает с увеличением объема заместителей R и R
и составляет, напр., при R = R = СН3 98,9°, R = R = Ph 109°,
R = R = CF3 105,6°, R = CH3, R = C(SCH3)3
118,5°.
Реакции по атому S. Co.-более
слабые основания, чем простые эфиры, но обладают большей нуклеофиль-ностью.
С разл. электроф. реагентами (к-ты Льюиса, соли тяжелых металлов) образуют донорно-акцепторные
комплексы. Р-ция С. о. с алкилиодидами, диалкилсульфатами и алкилсульфонатами,
а также со спиртами в присут. к-т приводит к солям сульфония (см. Сульфониевые соединения
), напр.: RRS + R:X:[RRSR:]+X-.
С. о., содержащие ви-нильную или арильную группу либо Hal, или др. электро-ноакцепторную
группу в a- и даже b-положениях, менее склонны к комплексообразованию.
С. о. окисляются Н2О2
в ледяной СН3СООН или ацетоне, а также орг. надкислотами в эквимолярных
кол-вах до сульфоксидов, при избытке этих же окислителей или при действии KMnO4,
HNO3 и т.п. образуются сульфоны. Окисление арилалкилсульфидов Сl2
или Вr2 в присут. Н2О используют для получения ароматич.
сульфонилгалогени-дов:
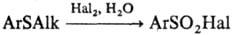
Фотоокисление бензилалкилсульфидов
сопровождается расщеплением
связи S—бензил: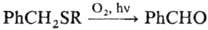 + RS(O)SR или RS(O2)SR.
+ RS(O)SR или RS(O2)SR.
Окислит. фторирование С.
о. действием F2, XeF2, C1F и т. п. приводит к образованию
RRSF2 или RRSF4, к-рыге при гидролизе дают соответствующие
сульфоксиды и сульфоны.
Реакции С. о. по органическим
радикалам. Атом S в орг. соединении стабилизирует карбанионы, карбка-тионы и
радикалы в a-положении; повышает СН-кислот-ность соед., к-рая возрастает
по мере накопления геми-нальных RS-групп. С. о., содержащие a-H-атом,
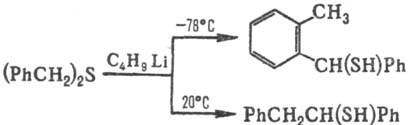
при взаимод. с RLi образуют устойчивые в р-ре Li-производные, напр.: RSCH3
+ C4H9Li : RSCH2Li+. a-Алкил(арил)тиоза-мещенные
соед. легко вступают в р-ции с участием карб-анионов, напр.:
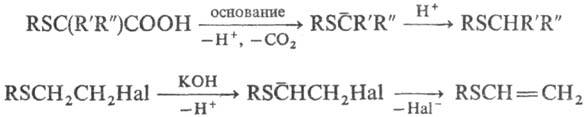
Аллилсульфиды подвергаются
анионотропной изомеризации в пропенилсульфиды:
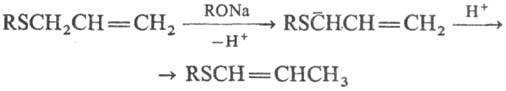
При действии галогенирующих
агентов на алифатич. сульфиды происходит замещение a-H-атомов на галоген,
напр.:
(CH3)2S
: CH3SCH2Cl : CH3SCHCl2
: CH3SCCl3 : : C1CH2SCCl3
: Cl2CHSCCl3
При дальнейшем хлорировании
расщепляются связи С—S. a-Хлор диалкилсульфиды-активные алкилирующие агенты.
Под действием оснований (NaOH или трет-
бутилат К) a-H-a-галогенсульфиды
образуют алкилтио- и арилтиокар-бены, фиксируемые разл. способами:
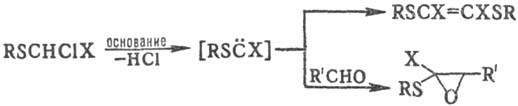
Гидролиз a-галогенсульфидов
протекает по механизму SNl до тиола, альдегида и HHal;
a,a-дигалогендиалкил-сульфиды гидролизуются до эфиров тиолкарбоновых
к-т:
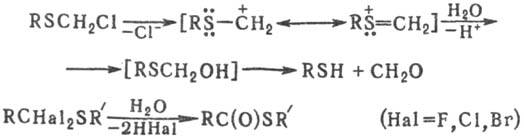
Для С. о., содержащих галоген
в b-положении, характерны р-ции нуклеоф. замещения (промежуточно образуются
эпи-сульфониевые соли):
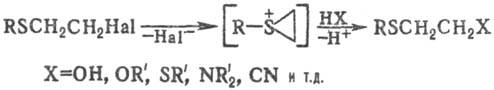
a, b-Ненасыщенные
С. о. вступают в реакции электроф. присоединения, а также в радикальные реакции;
винил-сульфиды способны к реакциям электроф. замещения b-H-атомов,
напр.:
В ароматич. ядре группа
RS активирует кольцо в р-циях электроф. замещения и ориентирует вступающие заместители
в орто-
и пара
-положения.
Реакции с расщеплением
связи С — S. Восстановители (LiAlH4, NaBH4, Na в жидком
NH3 и др.) расщепляют С. о. по схеме: RSR : RSH + RH. Легкость
расщепления зависит от природы орг. радикала (R) и уменьшается в ряду: алкинил
> винил ! аллил > алкил, а при R = Alk в ряду: третичный > вторичный
> первичный. Расщепление дибен-зилсульфидов под действием оснований сопровождается
в зависимости от условий перегруппировками Соммле или Стивенса:
При действии электроф.
реагентов (к-т, На12, HalCN и т.п.) образуются производные S(II),
напр.:
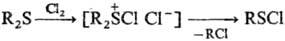
В случае несимметричных
С. о. отщепляется тот радикал, к-рый образует наиб. стабильный карбкатион. В
препаративных целях в качестве уходящей группы чаще всего используют бензильную
группу. Известно фотохим. и термич. расщепление С. о., напр.:
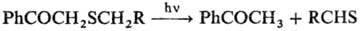
Основные методы получения
С. о. 1) Взаимод. неорг. сульфидов или тиолатов металлов с алкил(арил)-галогенидами,
сульфатами или тозилатами. Для получения диарилсульфидов применяют также р-ции
с солями арилдиазония.
2) Присоединение серосодержащих
реагентов к олефинам и ацетиленам; в отсутствие инициаторов и при кислотном
катализе присоединение происходит по правилу Марковни-кова, в присут. пероксидов
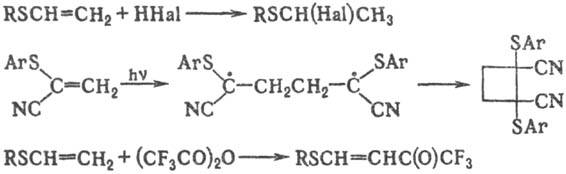
и при УФ облучении-против правила, напр.:
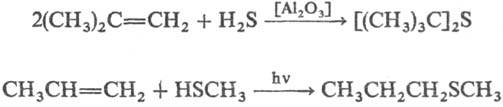
С олефинами, активированными
электроноакцепторными заместителями (COOR, CN, COR, SO2R и т.п.),
р-ция протекает в присут. основных катализаторов, напр.:
C2H5SH
+ CH2=CHCN : C2H5SCH2CH2CN
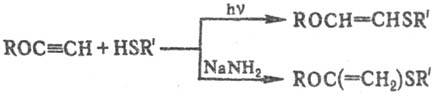
Присоединение меркаптанов
к производным ацетилена используют для получения ненасыщенных С. о., напр.:
b-Хлоралкилсульфиды
получают взаимод. олефинов с хлоридами серы или сульфенилхлоридами:
СН3СН=СН2
+ SCl2 : (CH3CHClCH2)2S СН2=СН2
+ PhSCl : PhSCH2CH2Cl
Диалкил(арил)дисульфиды
присоединяются к олефинам в условиях радикальной р-ции, напр.:
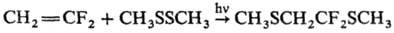
3) Р-ция H2S
с оксиранами-способ получения b-гидрок-сиалкилсульфидов, напр.:

4) Сульфенилирование ароматич.
соединении или СН-кис-лот в присут. соотв. к-т Льюиса или оснований. Сульфе-нилирующие
агенты -SCl2, S2Cl2 и производные сульфе-новых
к-т RSX (X = Cl, SR, NRJ, напр.:
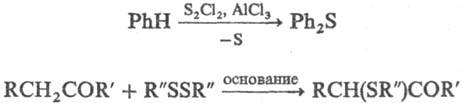
5) Десульфуризация диалкил(арил)дисульфидов
в присут. оснований или к-т Льюиса [SbF5, BF3, (RO)3P,
R3P и др.], в нек-рых случаях при нагр.: RSSR : RSR + S.
Для обнаружения С. о. используют
р-цию с солями тяжелых металлов (HgCl2, AuCl3, PtCl4
и др.) с образованием
нерастворимых в воде комплексных соед.; действие алкилгалогенидов, Сl2
или Вr2, либо хлорамина Т с образованием соотв. крнсталлич. солей
сулъфония, либо суль-финилиминов (CH3C6H4SO2N=SR2);
расщепление С. о. HI и последующее качеств, определение тиолов. Количеств. определение
проводят по кол-ву выделяющегося НВr при окислении С. о. бромной водой до сульфоксидов,
а также по образованию сульфонов при окисления надкислотами или озоном.
Применяют С. о. в качестве
одорантов горючих газов, антиоксидантов, стабилизаторов топлив, смазочных масел
и полимеров, ингибиторов радикальных р-ций в хим. пром-сти. В виде структурных
фрагментов С. о. входят в состав пестицидов, лек. ср-в, полимеров, вулканизатов,
ингибиторов коррозии. Диметилсульфид-сырье для получения диметилсульфоксида,
дивинилсульфид-мономер для получения ионообменных смол и адсорбентов. a-
и b-Га-логеналкилсульфиды- полупродукты в хим. и фармацевтич. пром-сти.
бис-(b-Хлорэтил)сульфид-ОВ (см. Иприт
).
При действии на организм
С. о. вызывают дистрофич. изменения внутр. органов, сосудистые расстройства.
а-Га-логеналкилсульфиды раздражают кожу, глаза и органы дыхания, в больших концентрациях
вызывают отек легких.
Лит.: Общая органическая
химия, пер. с англ., т. 5, М., 1983, с. 163-237; Сигэру Оаэ, Химия органических
соединений серы, М., 1975, с. 109-55; Коваль И. В., "Успехи химии",
1994, т. 63, в. 2, с. 154.
А. Ф. Ермолов.
|

