СУЛЬФИТЫ НЕОРГАНИЧЕСКИЕ
,
соли сернистой к-ты H2SO3. Различают средние сульфиты
(С.) с анионом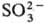 и кислые (гидросульфиты) с анионом
и кислые (гидросульфиты) с анионом 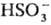 .
Средние С.-кристаллич.
в-ва (табл. 1). С. аммония и щелочных металлов хорошо раств. в воде; р-римость
(г в 100 г): (NH4)2SO3 40,0 (13 °С), K2SO3
106,7 (20 °С). В водных р-рах образуют гидросульфиты. С. щел.-зем. и нек-рых
др. металлов практически не раств. в воде; р-римость MgSO3 1 г в
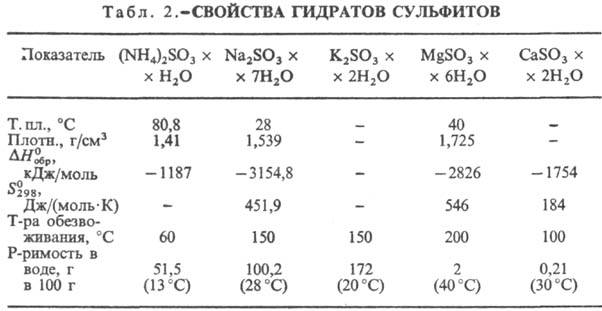
100 г (40°С). Известны кристаллогидраты (NH4)2SO3·Н2О,
Na2SO3·7H2O, K2SO3·2H2O,
MgSO3·6H2O и др. (табл. 2). Безводные С. при нагр. без
доступа воздуха в запаянных сосудах диспропорционируют на сульфиды и сульфаты,
при нагр. в токе N2 теряют SO2, а при нагр. на воздухе
легко окисляются до сульфатов. С SO2 в водной среде средние С. образуют
гидросульфиты. С.-относительно сильные восстановители, окисляются в р-рах хлором,
бромом, Н2О2 и др. до сульфатов. Разлагаются сильными
к-тами (напр., НСl) с выделением SO2.
.
Средние С.-кристаллич.
в-ва (табл. 1). С. аммония и щелочных металлов хорошо раств. в воде; р-римость
(г в 100 г): (NH4)2SO3 40,0 (13 °С), K2SO3
106,7 (20 °С). В водных р-рах образуют гидросульфиты. С. щел.-зем. и нек-рых
др. металлов практически не раств. в воде; р-римость MgSO3 1 г в
100 г (40°С). Известны кристаллогидраты (NH4)2SO3·Н2О,
Na2SO3·7H2O, K2SO3·2H2O,
MgSO3·6H2O и др. (табл. 2). Безводные С. при нагр. без
доступа воздуха в запаянных сосудах диспропорционируют на сульфиды и сульфаты,
при нагр. в токе N2 теряют SO2, а при нагр. на воздухе
легко окисляются до сульфатов. С SO2 в водной среде средние С. образуют
гидросульфиты. С.-относительно сильные восстановители, окисляются в р-рах хлором,
бромом, Н2О2 и др. до сульфатов. Разлагаются сильными
к-тами (напр., НСl) с выделением SO2.
Кристаллич. гидросульфиты
известны для К, Rb, Cs, NH4, они малоустойчивы. Остальные гидросульфиты
существуют только в водных р-рах. Плотн. NH4HSO3 2,03
г/см3; р-римость в воде (г в 100 г): NH4HSO3
71,8 (0°С), KHSO3 49 (20 °С).
При нагр. кристаллич. гидросульфитов
Na или К либо при насыщении SO2 кипящего р-ра пульпы M2SO3
образуются пиросульфиты (устаревшее - метабисульфиты) М2S2О5-соли
неизвестной в своб. состоянии пиросернистой к-ты H2S2O5;
кристаллы, малоустойчивы; плотн. (г/см3): Na2S2O5
1,48, K2S2O5 2,34; выше ~ 160 °С разлагаются
с выделением SO2; раств. в воде (с разложением до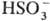 ),
р-римость (г в 100
г): Na2S2O5 64,4, K2S2O5
44,7; образуют гидраты Na2S2O5·7H2O
и 3K2S2O5·2H2O; восстановители.
),
р-римость (г в 100
г): Na2S2O5 64,4, K2S2O5
44,7; образуют гидраты Na2S2O5·7H2O
и 3K2S2O5·2H2O; восстановители.

Средние С. щелочных металлов
получают взаимод. водного р-ра М2СО3 (или МОН) с SO2,
a MSO3-пропусканием SO2 через водную суспензию МСО3
[или М(ОН)2]; используют в осн. SO2 из отходящих газов
контактных сернокислотных произ-в. С. применяют при отбеливании, крашении и
печатании тканей, волокон, кож [Na2S2O5, NaHSO3,
K2S2O5, KHSO3, CaSO3,
Ca(HSO3)2], для консервирования зерна, зеленых кормов,
кормовых пром. отходов (NaHSO3, Na2S2O5).
CaSO3 и Ca(HSO3)2-дезинфицирующие ср-ва в виноделии
и сахарной пром-сти. NaHSO3, MgSO3, КН4НSО3-комцоненты
сульфитного щелока при варке целлюлозы; (NH4)2SO3-
поглотитель SO2; NaHSO3-поглотитель H2S из
отходящих газов произ-в, восстановитель в произ-ве сернистых красителей. K2S2O5-компонент
кислых фиксажей в фотографии, антиоксидант, антисептик. См. также Натрия сульфит
. И. H. Один.
|

