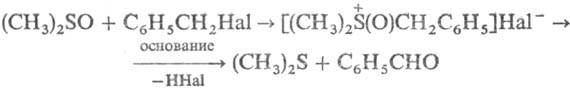|
Реклама |
|
|
 |
С.-очень слабые основания,
с сильными к-тами (НС1, HBr, HNO3) образуют соли типа R2SO
· НС1; под действием разл. реагентов, напр. Н2О2, окисляются
до сульфонов RRSO2; под действием восстановителей (LiAlH4,
NaBH4, H2 в присут. Pd, дихлорборан, трихлорсилан, Ph3P
и др.) образуют сульфиды RRS. Подобно карбонильным соед.,
конденсация С. с производными аминов и амидов приводит к сульфимидам RRS=NR:
(R-алкил, арил, ацил), а при одновременном окислении-к сульфоксимидам RRS(O)=NR:. Нуклеоф. св-ва С. проявляются
в легкости образования алкокси- и гидроксисульфониевых солей, что используется,
напр., для окисления бензил- и аллилгалогенидов или тозилатов: Под действием ангидридов
карбоновых к-т С. превращ. в a-ацилтиоэфиры (перегруппировка Пуммерера);
в случае несимметричных С. ацилоксигруппа присоединяется к наим. замещенному
атому С., напр.: (CH3)2CHS(O)CH3
+ (CH3CO)2O : (CH3)2CHSCH2OCOCH3 С. подвергаются перегруппировке
также под действием хлорангидридов карбоновых к-т, изоцианатов, неорг. галогенидов
(SiCl4, PC13, SO2C12 и др.), напр.: CH3S(O)CH3
+ С6Н5СОС1 : CH3SCH2Cl + С6Н5СООН При термолизе или в присут.
сильных оснований С. способны элиминировать сульфеновые к-ты, напр.: PhCH(CH3)CH(Ph)S(O)Ph
: PhC(CH3)=CHPh + [PhSOH] Действие гидридов или алкоголятов
металлов на С. приводит к реакционноспособным a-сульфинилкарбанионам типа
RS(O)CH2; действие реагентов, генерирующих положительно
заряженный галоген (NOCl, РhIСl2, Сl2, Вr2 и
др.),-к a-галогенсодержащим С. Получают С. окислением
сульфидов (окислители: оксиды азота, р-ры Н2О2, м-хлорнадбензойная
к-та, гипохлориты и др.); используют также р-ции сульфинатов и С. с ме-таллоорг.
соединениями, перегруппировку эфиров сульфено-вых к-т, присоединение монооксида
S к полиенам. Наиб. значение имеют диметилсульфоксид
и нефтяные С., получаемые окислением серосодержащих компонентов нефти. Нефтяные
С.-экстрагенты редких металлов, флотореа-генты цветных металлов. Лит.: Общая органическая
химия, пер. с англ., т. 5, М., 1983, с. 253-318. А.Ф.Елеев. |
||||||||||||||||||||||||||