СУРЬМАОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
,
содержат связь Sb-С. Для С. с. характерны соед. Sb(III) и Sb(V). Осн. типы соед.
Sb(III): R3Sb, R2SbX, RSbX2 (X-остаток минер.
или орг. к-ты, Н, OR, SR, NR металлы I-V групп и др.). Осн. типы соед. Sb(V):
R5Sb, R4SbX, R3SbX2, R2SbX3,
RSbX4. Известны также оксиды Sb(III) RSbO и (R2Sb)2O,
а также Sb(V) R3SbO, арилстибоновые и диарилстибиновые к-ты ArSb(OH)2O
и Ar2Sb(OH)O, С. с. с кратной связью Sb=C, напр, стибабензол (в молекуле
бензола один атом С заменен на атом Sb), и С. с. с кратной связью Sb=Sb, напр.
стибино-бензол PhSb=SbPh. В большинстве С. с. атом Sb имеет координац. числа
3 и 5, однако описаны соед. Sb(III) с коор-динац. числами 2 (напр., стабабензол),
4 (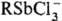 ) и соед. Sb(V)
с координац. числами 4 (стибониевые соли R4Sb+X-),
6 ([Ph6Sb]-M+).
) и соед. Sb(V)
с координац. числами 4 (стибониевые соли R4Sb+X-),
6 ([Ph6Sb]-M+).
Соединения Sb(III).
Соединения Alk3Sb-бесцветно перегоняющиеся жидкости, легко окисляются
О2 воздуха (иногда с самовоспламенением), при осторожном окислении
образуют R3SbO; устойчивы к действию воды и разбавленных кислот,
при реакции с галогенами дают R3SbHal2.
Соед. Аr3Sb-кристаллич.
в-ва, устойчивы к влаге и О2 воздуха, при действии к-т легко отщепляют
Аr, напр. Ar3Sb + НХ : Ar2SbX + АrН.
Соед. R3Sb,
благодаря наличию своб. пары электронов у атома Sb, могут образовывать комплексы,
напр. с R3A1, или служить лигандами в координац. сфере переходного
металла. Описано расщепление соед. RRR:Sb на энантио-меры.
Соед. RnSbX3_n
(n = 1,2) легко окисляются и гидролизу-ются с образованием оксидов; при
восстановлении дают гидриды RnSbH3_n;
гидриды алкилсурьмы чрезвычайно неустойчивы, напр.: CH3SbH2
разлагается при — 80 °С, а (СН3)2SbН-при комнатной
т-ре, образуя самовоспламеняющийся на воздухе тетраметилдистибил [(CH3)2Sb]2,
гидриды арилсурьмы более устойчивы. При действии щелочных металлов на R2SbHal
образуются R2SbM (М = Li, Na), к-рые используют
для синтеза С. с., содержащих связь Sb с др. металлами, напр. Ph2SbNa
+ SnCl4 : (Ph2Sb)4Sn. К соед. R2SbM
приводят также р-ции R2SbH с RLi или R3Sb с NaNH2.
Галогены окисляют R2SbHal и RSbHal2 до R2SbHal3
и RSbHal4.
Оксиды (R2Sb)2O-кpиcтaллич.
в-ва мономерной структуры, RSbO - аморфные порошки полимерной структуры; соед.
ArSbO неустойчивы и разлагаются по ур-нию: 4ArSbO : (Ar2Sb)2O
+ Sb2O3.
Осн. методы синтеза R3Sb:
1) взаимод. магний- или ли-тийорг. соед. с SbHal3, в контролируемых
условиях можно получить R2SbHal и RSbHal2; в пром-сти
используют р-цию алюминийорг. соед. с Sb2O3 и SbF3
либо электролиз алю-минийорг. соед. на аноде из Sb; соед., в к-рых R = винил,
получают взаимод. ртутьорг. соед. с SbX3; 2) по р-ции Вюрца-Михаэлиса
SbCl3 + 6Na + 3PhCl : Ph3Sb + 6NaCl; 3) присоединением
гидридов Sb к кетону, алкинам и др.
При восстановлении R3SbX2,
диарилстибиновых и арил-стибоновых к-т образуются соответственно R3Sb,
Ar2SbX и ArSbX2; при разложении R3SbX2
и R2SbX3-соответственно R2SbX и RSbX2;
нагревание Sb с RX (R = Alk, Ph, винил) в присутствии Си приводит к смеси R2SbX
и RSbX2; р-ция R2SbNa с RX дает R2SbR. Для
получения ArSbO и Ar2SbX используют разложение двойных диазониевых
солей порошком Zn (диазометод Несмеянова), напр.:
ArN2Cl · SbCl3
+ Zn + Н2O :
ArSbO + N2 + ZnCl2 + 2HC1
[ArN2Cl]2SbCl3
+ 2Zn : Ar2SbCl + 2N2 + 2ZnCl2 .
Нек-рые соед. Sb(III) синтезируют
с использованием олово- и свинецорг. соед., напр. Ph4Sn + SbCl3
: Ph2SbCl + + Ph2SnCl2.
Соединения Sb(V). Соед.
R5Sb-термически устойчивые, перегоняющиеся жидкости (R = низший алкил)
либо кри-сталлич. в-ва (R = арил), быстро разлагающиеся на воздухе. Структура
Alk5Sb-тритон. бипирамиды, Ph5Sb и (цикло-C6H11)5Sb-квадратные
пирамиды. В р-ре R5Sb легко обменивают орг. радикалы между разл.
положениями. При взаимод. R5Sb с разл. электрофилами в мягких условиях
отрывается один R и образуются производные типа R4SbX (X = ОН, Hal
и др.). Р-ции Ar5Sb с ArLi приводят к ионным комплексам Li[Ar6Sb].
Соед. RnSbX5_n
(n = 3,4)-устойчивые кристаллич. в-ва, построенные по ковалентному типу
с тригонально-бипира-мид. расположением лигандов. Если Х-бидентатный ли-ганд,
то атом Sb из 5-координационного становится 6-коор-динационным. Частичный Гидролиз
R3SbHal2 приводит к (R3SbHal)2O,
полный гидролиз-к R3SbO. При действии к-т на R3SbO образуются
R3SbX2 (Х-остаток минер. или орг. к-ты, SR и др.). Другие
соед. этого типа, такие, как R2SbHal3 и RSbHal4
(R = алкил),-неустойчивы и поэтому практически не изучены. Более устойчивы алкоксипроизвод-ные
R2Sb(OR)3, к-рые при р-ции с карбоновыми к-тами образуют
R2Sb(OCOR:)3.
Восстановление RnSbX5_n,
в отличие от RnSbX3_n, не приводит
к гидридам.
Соед., содержащие арильный
радикал, устойчивее своих алкильных аналогов. При гидролизе Ar2SbCl3
образуются диарилстибиновые к-ты, при гидролизе ArSbHal4-арилстибоновые
к-ты.
Общий метод синтеза R5Sb-взаимод.
R3SbX2 с RLi или RMgX. Для получения RnSbCl5_n
используют р-цию ацетилена с SbCl5 или галогенсодержащими С. с.,
напр.
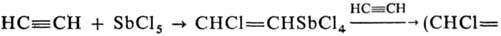
=CH)2SbCl3.
При действии НХ на R5Sb образуются R4SbХ, при окислении
R3Sb или R2SbHal галогенами соотв. R3SbX2
и R2SbX3.
Арилсодержащие С. с. получают
из диазосоединений по р-циям:
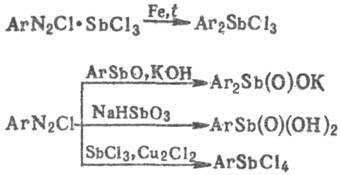
Нек-рые С. с. [напр., галогениды
и оксиды Sb(III)] раздражают кожу и слизистые оболочки.
С. с. применяют в качестве
лек. препаратов, биоцидов и фунгицидов. Они м.б. использованы как компоненты
катализаторов полимеризации, антиоксидантов, добавок к маслам и др.
Лит.: Методы элементоорганической
химии. Сурьма, висмут, под ред. А. Н. Несмеянова, К. А. Кочешкова, М., 1976;
Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. 2, Oxf., 1982,
p. 681-707. А. С. Перегудов.
|

