СУРЬМЫ ОКСИДЫ
. Сесквиоксид
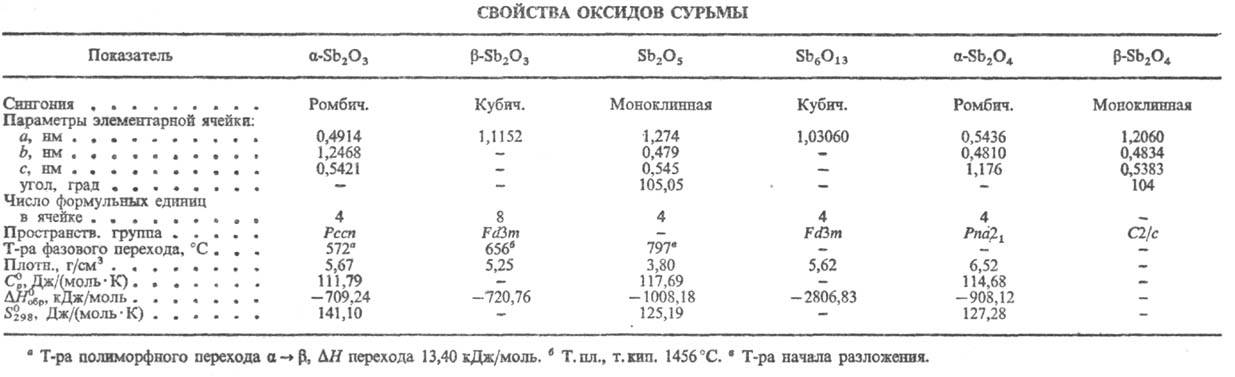
[оксид Sb(III)] Sb2O3-бесцв. кристаллы (см. табл.), существует
в a- (минерал валентинит) и b-формах (минерал сенармонтит); практически
не раств. в воде. Устойчивая форма в газовой фазе-димер Sb4O6,
образуется при горении или обжиге сульфидных руд сурьмы на воздухе. Sb2O3
получают конденсацией паров Sb4O6. Он м.б. получен также
прокаливанием гид-роксида Sb(OH)3, к-рыи выделяется в виде геля при
гидролизе галогенидов Sb(III).
При обработке Sb(OH)3
щелочью образуется соль очень слабой (К ~ 10-11) метасурьмянистой
к-ты-антимо-нат(III), напр. KSbO2. Антимонат К хорошо раств. в воде,
в отличие от NaSbO2, выпадающего из р-ра в виде кристаллогидрата
NaSbO2 · 3H2O.
Оксид сурьмы(V) Sb2O5-желтые
кристаллы; практически не растворяются в воде; получают окислением Sb2O3
кислородом под давлением в неск. десятков МПа при 700-900 °С.
Гидролизом пентагалогенидов Sb, действием HNO3 на р-р К[Sb(ОН)6]
или ионным обменом на катио-ните в H-форме получают аморфный гидратированный
Sb2O5·nH2O, где n = 1-4, 6 и
зависит от условий старения осадка. При его прокаливании при 380 °С образуется
тетра-гидрат Sb2О5·4Н2О-бесцв. кристаллы кубич.
сингонии типа пирохлора (а=1,0384нм, пространств. группа Fd3m);
плотн. 4,27 г/см3. С р-рами щелочей он образует анти-монаты(У)-соли
сурьмяной к-ты H[Sb(OH)6], известной только в р-ре (К ~ 4·10
-5). Получен хорошо р-римый в воде антимонат K[Sb(OH)6],
к-рый применяют в аналит. химии для обнаружения Na в виде Na[Sb(OH)6].
Безводные антимонаты(V) разл. металлов получают спеканием их оксидов с Sb2O5.
Их состав соответствует солям ортосурьмя-ной Н3SbО4, пиросурьмяной
H4Sb2O7 и метасурьмя-ной HSbO3 к-т,
хотя существование самих к-т не установлено.
При отжиге гидратированного
Sb2O5 при 300-500 °С наряду с отщеплением воды выделяется
О? и образуется оксид Sb6O13, в к-ром соотношение
Sb(V):Sb(III) = 2:1. Его получают также прокаливанием смеси Sb2O3
и Sb2O5·nН2О при 500-750 °С.
Конечный продукт прокаливания
Sb2O5·nH2O при т-рах выше 800°С-диоксид
Sb2O4, или Sb2О3·Sb2О5,-бесцв.
кристаллы, существует в двух модификациях a (минерал сервантит) и b.
Диоксид получают также длит. прокаливанием смесей Sb2О3
и Sb2О5·nН2О при т-рах выше 750 °С.
В газовой фазе также обнаружен монооксид SbO.
Оксид Sb(III) используют
для получения Sb высокой чистоты, как компонент оптич. стекла и эмалей, наполнитель
термостойких дластмасс, пигмент для красок, протраву и антипирен для тканей.
Оксид Sb(V) входит в состав люминофоров для люминесцентных ламп дневного света,
его используют в текстильной и резиновой пром-сти, в про-из-ве спец. стекла,
керамики, красок, лаков. Гидратированный Sb2О5-ионообменник
с высокой ионообменной емкостью и селективностью. Катализаторы на основе С.
о. и антимонатов(V) ряда металлов применяют для парциального окисления углеводородов.
На пов-сти монокристаллич. полупроводников типа AIIIBV
(GaSb, InSb и др.) образуются тонкие пленки собств. оксидов, в состав к-рых
входят С. о. и антимонаты(V) АSbО4, определяющие стабильность полупроводниковых
структур.
С. о. токсичны, ПДК в воздухе
рабочей зоны Sb2О3 1,0 мг/м3, Sb2O5
2,0 мг/м3.
Лит.: Дзисько В.
А., Карнаухов А. П., Тарасова Д. В., Физико-химические основы синтеза окисных
катализаторов, Новосиб., 1978; Гидратирован-ные оксиды элементов IV и V групп,
М., 1986. В. И. Белый
.
|

