ТВЕРДЫЕ РАСТВОРЫ
,
однородные (гомогенные) крис-таллич. фазы переменного состава; образуются в
двойных или многокомпонентных системах. Если компоненты системы неограниченно
р-римы друг в друге, они образуют непрерывный ряд Т. р. Чаще, однако, концентрация
растворенного в-ва не может превышать нек-рое предельное значение и существование
Т. р. ограничено нек-рыми областями составов (области гомогенности). Т. р. являются
мн. метал-лич. сплавы и неметаллич. системы - минералы, стекла, полупроводники,
ферриты.
Типы диаграмм состояния.
На диаграмме состояния
двойных систем в координатах т-ра-состав образованию
непрерывных Т. р. отвечают три типа линий ликвидуса и солидуса (рис. 1, а,
б и в), отграничивающих области существования жидкой фазы (расплава) и Т.
р. (Ж и a соотв.) и область сосуществования обеих фаз (Ж + a). Тип
б встречается крайне редко, гл. обр. в случае оптич. изомеров орг. в-в.
В системах с непрерывными Т. р., согласно принципу соответствия (см. Физико-химический анализ
), должна быть только одна кривая ликвидуса и одна кривая солидуса.
Поэтому в точке минимума или максимума происходит плавный переход одной части
кривой в другую.
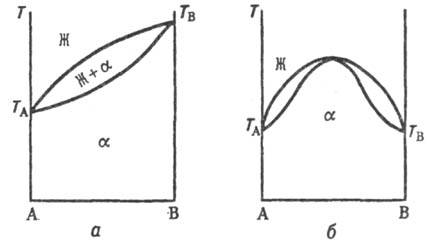
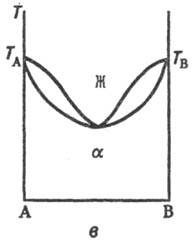
Рис. 1. Диаграммы состояний
двойных систем в координатах т-ра Т-состав А-В: Ж-жидкая фаза (расплав),
a-непрерывный твердый р-р, ТА и TB-т-ры
плавления чистых компонентов.
Если компоненты образуют
только ограниченные Т. р., возможны два типа диаграмм состояния (рис. 2), на
к-рых Т. р. компонента А в В, обозначаемые как a-p-p, образуются лишь до
определенной концентрации В, а Т. р. В в А (р-р-р)-до определенной концентрации
А. В первом случае Т.р. образуют эвтектику, т.е. существует точка E нонва-риантного равновесия трех фаз: жидкого расплава, состав к-рого отвечает
точке E, твердого a-р-ра, концентрация к-рого соответствует точке
F, и твердого b-p-pa, концентрация к-рого отвечает точке G, причем
точка E лежит между точками состава этих Т. р. Ниже т-ры ТЕ
остаются в равновесии два Т. р. a и b, составы к-рых по мере снижения
т-ры изменяются в соответствии с ходом линий GM и FN (рис. 2,
а). Образование подобных Т. р. наблюдается, напр., в системах Сu-Ag,
Pb-Sn. Во втором случае Т. р. Образуют перитектику-нонвариантную точку также
трехфазного равновесия, но расположенную по одну сторону от точек состава Т.
р. (точка Р, рис. 2,б). Примером системы пе-ритектич. типа может
служить Cd-Hg.
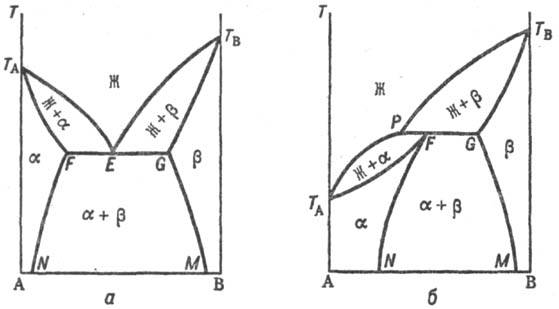
Рис. 2. Диаграммы состояния
двойных систем с ограниченными по составу твердыми р-рами a и b: а-система
с эвтектич. точкой Е; б-система с пери-тектич. точкой Р. Остальные
обозначения те же, что и на рис.1.
На линиях ликвидуса ограниченных
Т. р. иногда встречаются экстремальные точки-минимум или (чаще) максимум. Последнее
характерно для солевых и оксидных систем только в случае гетеровалентных Т.
р. (см. ниже) с переменным числом ионов в элементарной ячейке, напр. Т. р. Y2О3
в ZrO2. Повышение температуры плавления при образовании такого
Т. р., напр. DyF3 в PbF2, м. б. настолько сильным, что
температура плавления эвтектич. смеси (957 °С) становится выше температуры
плавления компонента (для PbF2 824 °С).
Распад Т. р. Предельная
концентрация Т. р. зависит от т-ры и давления. При понижении т-ры взаимная р-римость
компонентов, как правило, понижается. Влияние давления неоднозначно, для большинства
систем повышение давления приводит к уменьшению взаимной р-римости.
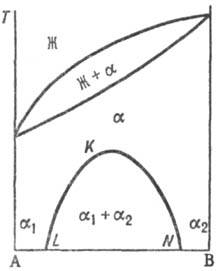
Рис. 3. Распад непрерывного
твердого р-ра с образованием двухфазной системы. Жирная линия - бинодаль, отделяющая
область существования твердого р-ра от области сущестзова-ния двухфазной системы.
При охлаждении однородного
р-ра ниже критич. т-ры р-римости (смешения) (точка К) образуется двухфазная
система, состоящая из несмешивающихся Т. p. a1 и a2
(рис. 3), составы к-рых изменяются с т-рой по линиям KL и KN соответственно. Др. тип распада Т. р. a наблюдается, если компоненты
А и В могут образовать хим. соед. АmВn (рис.
4), характеризующееся упорядоченным расположением частиц (атомов или ионов)
в кристаллической решетке, в отличие от статистического беспорядка в расположении
частиц, характерного для Т. р. На основе АmВn
образуется Т. р. b с компонентами А и В. Превращение в упорядоченную фазу
(сегрегация) может происходить как фазовый переход
II рода. При
этом выше температуры перехода вероятности заполнения к.-л. кристаллографич.
позиции разл. атомами (ионами) равны, а ниже точки перехода различаются.
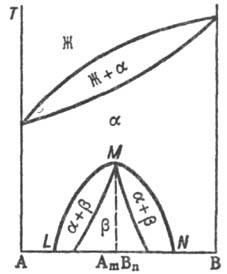
Рис, 4. Распад непрерывного
твердого р-ра с образованием хим. соед. АmВn.
Жирная линия-т-ра начала кристаллизации твердого р-ра b на основе АmВn.
Полиморфизм. С полиморфным
превращением в-ва, на основе к-рого образуется Т. р;, всегда связано и превращение
Т. р. На рис. 5 приведены диаграммы состояния систем с наиб. часто встречающимися
вариантами полиморфного превращения. При эвтектоидном превращении (рис. 5, а)
т-pa трехфазного равновесия (точка E) T. р. a и b, образующихся
на основе двух модификаций компонента А, с Т. р. g на основе компонента
В расположена ниже т-ры Тн полиморфного превращения, а область гомогенности
Т. р. на основе низкотемпературной модификации (b) уже, чем на основе высокотемпературной
(a); при перитектоидном (рис. 5, б)-наоборот.
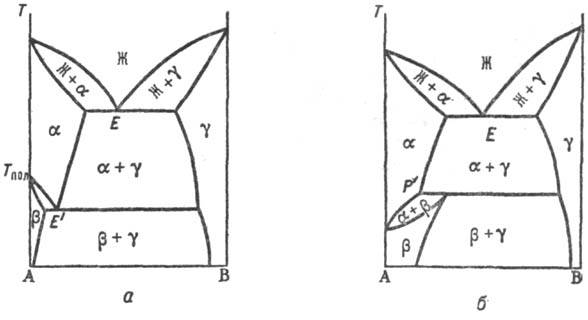
Рис. 5. Диаграммы состояния
двойных систем с полиморфным превращением твердого р-ра по эвтектоидному типу
(а) и по перитеггоидному типу (б).
Типы Т.р. В Т.р.
замещения растворенное в-во замещает исходное-атом на атом, ион на ион или молекула
на молекулу. При этом число частиц (атомов, молекул) в элементарной кристаллич.
ячейке остается постоянным. Один из важнейших факторов, определяющих возможность
образования Т. р. замещения,-это размеры замещающих друг друга атомов (ионов,
молекул). Согласно правилу Гольдшмидта, для образования широких по составу областей
гомогенности Т. р. при т-рах, далеких от т-р плавления компонентов, разница
Dr в ионных радиусах замещающих друг друга ионов не должна превышать
15%, т.е. отношение Dr/r 15%
(r-меньший радиус). Аналогичное правило 15%-ного различия атомных диаметров
для Т. р. металлов и ковалентных в-в было установлено В. Юм-Розери (1934). В
настоящее время чаще используется др. размерный фактор-межатомное расстояние
R. Для хим. соединения с преим. ионной связью непрерывные Т. р. замещения
образуются при всех т-рах, если DR/R < 4 — 5% (А. С. Поваренных,
1964). Если DR/R лежит в пределах от 15 до 20-25%, то даже
при высоких т-рах образуются только ограниченные Т. р., а при DR/R > 20-25% заметное взаимное
растворение отсутствует. Используют и др. размерные факторы: параметры кристаллич.
решетки, молярные объемы и т.п. При этом роль размерных факторов зависит от
типа хим. связи. Чем сложнее хим. соед., тем, как правило, шире области гомогенности
Т. р. замещения. В случае молекулярных кристаллов
, в частности
органических, возможность образования Т. р. замещения определяется не только
размером, но и конфигурацией молекул.
15%
(r-меньший радиус). Аналогичное правило 15%-ного различия атомных диаметров
для Т. р. металлов и ковалентных в-в было установлено В. Юм-Розери (1934). В
настоящее время чаще используется др. размерный фактор-межатомное расстояние
R. Для хим. соединения с преим. ионной связью непрерывные Т. р. замещения
образуются при всех т-рах, если DR/R < 4 — 5% (А. С. Поваренных,
1964). Если DR/R лежит в пределах от 15 до 20-25%, то даже
при высоких т-рах образуются только ограниченные Т. р., а при DR/R > 20-25% заметное взаимное
растворение отсутствует. Используют и др. размерные факторы: параметры кристаллич.
решетки, молярные объемы и т.п. При этом роль размерных факторов зависит от
типа хим. связи. Чем сложнее хим. соед., тем, как правило, шире области гомогенности
Т. р. замещения. В случае молекулярных кристаллов
, в частности
органических, возможность образования Т. р. замещения определяется не только
размером, но и конфигурацией молекул.
Размерный фактор не всегда
является решающим. Напр., NaCl и PbS не образуют Т. р., хотя их размерные факторы
(радиусы ионов, межатомные расстояния и др.) близки. Второй необходимый фактор-хим.
подобие компонентов, в частности близость типа хим. связи. В качестве параметра,
определяющего возможность образования Т. р. замещения, используют различие в
степени ионности связи, иногда -разность электроотрицательностей
атомов
замещающих друг друга элементов. Предложено использовать в качестве характеристик
хим. подобия т-ры плавления хим. соед. или энергии 17 кристаллич. решеток. Для
образования непрерывных Т. р. замещения требуется, чтобы DTпл/Tпл 27%,
DU/U < 10%. В случае мол. кристаллов важное значение имеет наличие
у обоих компонентов водородных связей, а также существование у молекул собств.
дипольного момента. В частности, практически неизвестны Т. р. на основе льда,
т. к. нет подобных ему в-в по указанным характеристикам.
27%,
DU/U < 10%. В случае мол. кристаллов важное значение имеет наличие
у обоих компонентов водородных связей, а также существование у молекул собств.
дипольного момента. В частности, практически неизвестны Т. р. на основе льда,
т. к. нет подобных ему в-в по указанным характеристикам.
В Т.р. внедрения атомы
(молекулы) растворенного в-ва располагаются в междоузлиях кристаллич. решетки,
образованной в-вом-основой Т. р., или в стехиометрич. вакансиях. В результате
число атомов (молекул) в элементарной ячейке кристалла увеличивается. Классич.
пример Т. р. внедрения-р-ры неметаллов H, N, С, О в металлах. В Т.
р. на основе In2Те3, обладающего дефектной структурой
типа сфалерита, примесные атомы Sb, Bi, In и др. располагаются в стехиометрич.
вакансиях. Т. р. внедрения являются р-ры воды в цеолитах-
молекулы воды
располагаются в полостях структуры осн. в-ва. При образовании Т. р. внедрения
не требуется близости типа хим. связи, а размерный фактор может играть роль,
противоположную Т. р. замещения, а именно: макс. взаимной р-римости компонентов
благоприятствует наиб. разница их атомных радиусов.
В Т.р. вычитания число
атомов в элементарной ячейке кристалла уменьшается по сравнению с чистым компонентом.
Такие Т. р. часто образуются на основе нестехиомет-рич. соединении. Так, в сульфиде
железа Fe1-xS, к-рый можно рассматривать как Т. p. S в FeS,
в действительности имеются своб. октаэдрич. пустоты -катионные вакансии-вследствие
того, что часть атомов железа имеет степень окисления III. Т. р. калия в КСl-также
Т. р. вычитания. В его решетке существуют анионные вакансии, в к-рых локализуются
электроны, что обеспечивает электрич. нейтральность кристаллич. решетки. В пределах
области гомогенности одной и той же фазы могут наблюдаться как Т. р. внедрения,
так и Т. р. вычитания, поэтому иногда эти типы Т. р. объединяют под назв. "Т.
р. с переменным числом атомов в элементарной ячейке".
Т. р. как внедрения, так
и замещения м.б. неупорядоченными-со статистич. распределением атомов в решетке
либо частично или полностью упорядоченными, с определенным расположением атомов
разного сорта относительно друг друга. Упорядоченные Т.р. иногда наз. сверхструктурами.
В нек-рых случаях в Т. р. атомы одного сорта могут образовывать скопления, к-рые,
в свою очередь, могут определенным образом упорядочиваться или ориентироваться
в данном направлении. Т. обр., Т. р., будучи истинно гомогенным в макроскопич.
масштабе, т.е. система, находящаяся в термодинамич. равновесии, м.б. неоднородной
при рассмотрении на микроуровне. Эксперим. данные об упорядочении Т. р. получают
в осн. при использовании рентгеновского структурного анализа
. Упорядоченность
Т. р. и ее изменения в процессах старения важны для материаловедения (см. Сплавы
).
Гетеровалентные Т. р. образуются
хим. соединениями, включающими катионы или анионы в разных степенях окисления.
Механизм образования таких Т. р. может быть различным. Это могут быть Т. р.
замещения, если происходит одновременное замещение двух видов атомов или ионов
(двойное замещение). Так, в полевых шпатах (плагиоклазах) Т. р. образуется в
результате замещения пары Na+ + Si4+ на пару Са2+
+ Аl3+ . В сиалонах (Si3_xAlx)(N4_xOx)
-Т. р. на основе b-нитрида кремния - происходит одновременная замена Si
на Аl и N на О. Возможны гетеровалентные Т. р. замещения и вычитания. Так,
в Т. p. AgCl и CdCl2 замещение иона Ag+ на Cd2+
сопровождается образованием катионной вакансии. При растворении СаО в кубич.
модификации ZrO2 замещение катионов Zr4+ на Са2+
сопровождается образованием кислородной вакансии. Замещение может сопровождаться
внедрением в кристаллич. решетку дополнит. катионов или анионов. Так, фториды
щел.-зем. металлов растворяют фториды РЗЭ; при этом дополнит. анионы F располагаются
в октаэдрических междоузлиях структуры флюорита. В щелочных бериллах часть атомов
Be замещается Li, одновременно дополнит. катионы Na или Cs располагаются внутри
каналов из силикатных колец Si6O18.
При образовании гетеровалентных Т. р. с изменением
числа атомов в элементарной
кристаллич. ячейке оптим. размер иона-заместителя не совпадает с размером замещаемого
иона. А.Е.Ферсман (1933) полагал, что наиболее благоприятна для образования
Т. р. ситуация, когда ион-заместитель, несущий больший электрический заряд,
имеет и больший радиус. Однако часто, напр. при образовании Т. р. сульфатов
двухвалентных металлов в сульфатах Na или К, наблюдается обратная зависимость.
Вообще размерный фактор иногда очень сильно, а иногда относительно слабо влияет
на ширину областей гомогенности таких Т. р., в зависимости от природы соединения-основы.
Нек-рые гетеровалентные
Т. р. (напр., КС1О4 в BaSO4 или KBF4 в SrSO4)
относятся к числу т. наз. аномальных Т. р., в к-рых наблюдается ниж. температурный
предел смешения или при понижении концентрации коэф. сокрис-таллизации стремится
к 0 (см. Соосаждение
). Это объясняется замещением отдельных блоков
элементарных ячеек, так что образуется не истинный, а микродисперсный ("коллоидный")
Т. р.
Выяснение механизма образования
Т. р. требует применения физ. методов исследования, в частности рентгеновского
структурного анализа. К числу наиб. часто применяемых методов исследования Т.
р. относится рентгенография
порошков. Параметры кристаллич. решетки Т.
р. линейно зависят от состава (Л. Вегард, 1921); реально наблюдаются отклонения
от этого правила. Широко используют также измерения плотности; согласно правилу
Ретгерса (1889), плотность, а также молярный объем аддитивно зависят от концентрации.
Измерение т-р фазовых переходов (см. Термография
) позволяет строить
диаграммы р-римости с их последующим физико-химическим анализом.
Для Т. р., как и для жидких
растворов, применяют термодинамические модели и рассматривают идеальные Т. р.,
в к-рых энтальпия смешения равна нулю, регулярные, субрегулярные Т. р. (см. Растворы неэлектролитов
).
Природные кристаллич. в-ва
(минералы) и синтетич. кристаллы представляют собой многокомпонентные Т. р.;
даже в-ва высокой чистоты с очень малым содержанием примесей являются Т. р.
Как было показано Н. С. Курна-ковым и С.Ф.Жемчужным (1906), св-ва Т.р. отличаются
(иногда очень сильно) от св-в чистых компонентов. В частности, при образовании
Т. р. на основе металла возрастает твердость и уменьшается электропроводность
в-ва. Изменение состава Т. р. позволяет изменять в широких пределах св-ва сплавов,
полупроводниковых материалов, ионных проводников, ферритов, лазерных материалов
и т. п. и получать материалы с нужными св-вами (см. Легирование
).
Св-ва
Т. р. могут изменяться
в результате термич. обработки, к-рая позволяет получать Т. р. либо в неравновесном
состоянии (закалка), либо в состоянии, в той или иной степени приближенном к
равновесному (отжиг, отпуск). Термин "Т. р." предложен Я. Вант-Гоффом
в 1890.
Лит.: Макаров Е.
С., Изоморфизм атомов в кристаллах, М., 1973; Хачатурян А. Г., Теория фазовых
превращений и структура твердых растворов, М., 1974; Урусов В. С., Теория изоморфной
смесимости, М., 1977; его же, Теоретическая кристаллохимия, М., 1987; Федоров
П. П., Соболев Б. П., Федоров П. И., "Кристаллография", 1981, т.
26, № 3, с. 512-20; Китайгородский А. И., Смешанные кристаллы, М., 1983. П.И.
Федоров,
|

