ТЕЛЛУРА ОКСИДЫ.
Оксид ТеО известен в газовой фазе: 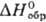 72,4 кДж/моль,
72,4 кДж/моль, 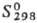 241,7
Дж/(моль·К). Диоксид ТеО2
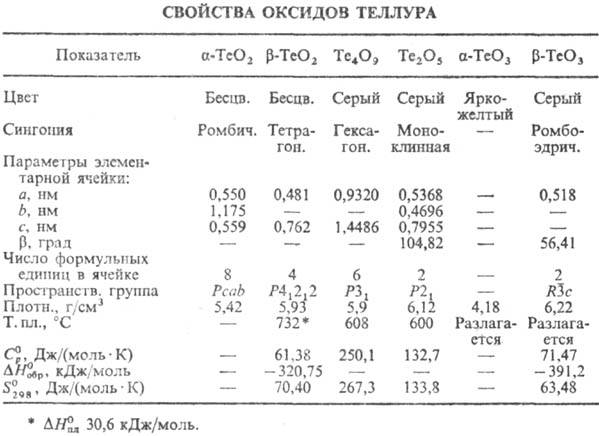
существует в виде двух кристаллич. модификаций: a и
b (см. табл.); т-ра перехода a
: b 485 °С, DH
перехода 0,98 кДж/моль. a-ТеО2 (минерал
теллурит) образуется при дегидратации Н2ТеО3 при рН <
2 и т-ре ниже 5 °С. р-ТеО2 (минерал парателлурит) при комнатной
т-ре и давлении 0,9 ГПа претерпевает фазовый переход второго рода, а при ~ 3 ГПа
- полиморфный переход с образованием ромбич. модификации (а = 4,22 нм,
b = 4,84 нм, с = 0,367 нм); возгоняется, ур-ние температурной зависимости
давления пара lgp(Па) = - 13222/T+ 14,508;
241,7
Дж/(моль·К). Диоксид ТеО2
существует в виде двух кристаллич. модификаций: a и
b (см. табл.); т-ра перехода a
: b 485 °С, DH
перехода 0,98 кДж/моль. a-ТеО2 (минерал
теллурит) образуется при дегидратации Н2ТеО3 при рН <
2 и т-ре ниже 5 °С. р-ТеО2 (минерал парателлурит) при комнатной
т-ре и давлении 0,9 ГПа претерпевает фазовый переход второго рода, а при ~ 3 ГПа
- полиморфный переход с образованием ромбич. модификации (а = 4,22 нм,
b = 4,84 нм, с = 0,367 нм); возгоняется, ур-ние температурной зависимости
давления пара lgp(Па) = - 13222/T+ 14,508;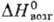 264
кДж/моль; в паре обнаружены
молекулы (ТеО2)n, Те2, О2,
где n=1,2,3,4, а также Те2 и О2; полупроводник p-типа;
характеризуется высокими значениями показателя преломления, акустооп-тич. качества
(см. Акустические материалы
), пьезоэлектрич. св-вами. Восстанавливается
до Те при нагр. с Al, Cs, Zn, С, S, ZnS, HgS, PbS.
264
кДж/моль; в паре обнаружены
молекулы (ТеО2)n, Те2, О2,
где n=1,2,3,4, а также Те2 и О2; полупроводник p-типа;
характеризуется высокими значениями показателя преломления, акустооп-тич. качества
(см. Акустические материалы
), пьезоэлектрич. св-вами. Восстанавливается
до Те при нагр. с Al, Cs, Zn, С, S, ZnS, HgS, PbS.
TeO2 практически
не раств. в воде, хорошо раств. в р-рах щелочей и соляной к-те, хуже-в HNO3
и H2SO4. При растворении в конц. к-тах образуются соли,
напр. ТeI4, Te2O3(OH)NO3, Te2O3SO4.
При растворении ТеО2 в р-рах щелочей или при спекании с карбонатами
металлов образуются теллуриты-соли теллуристой к-ты H2TeOs (K1
3·10-6). Однако в индивидуальном состоянии она не получена, т.к.
при выделении из р-ра дегидратируется до xТеО2·yН2О,
а затем до ТеО2. Теллуриты щелочных металлов-кристаллич. в-ва, раств.
в воде; используются в произ-ве оптич. стекол.
Получают a-ТеО2
окислением Те кислородом, смесью HNО3 и НС1, термич.
разложением H6ТеО6, действием NH3
на Н2ТеО3. Монокристаллы b-TeО2
выращивают из расплава по методу Чохральского или гидротермальным синтезом.
b-TeО2-материал для акустооптич. устройств, компонент
оптич. стекол.
Триоксид ТеО3
известен в двух формах - аморфной a и кристаллич. b. a-ТеО3
разлагается выше 360 °С до ТеО2 с промежут. образованием Те2О5
и Те4О9; парамагнетик; сильный окислитель, легко реагирует
с Al, Sn, С, Р, S; восстанавливается до ТеО2 при кипячении в конц.
соляной к-те. a-ТеО3 раств. в конц. р-рах щелочей, горячей соляной
к-те. Медленно взаимод. с водой с образованием слабой ортотеллуровой к-ты Н6ТеО6-бесцв.
кристаллы; существует в двух формах -кубич. a и моноклинной b; при
нагр. b-форма переходит в a; при нагр. до 300-320 °С и давлении
10-1 Па разлагается с образованием ТеО3 x x
xH2О, где x = 0,01 — 0,15, к-рый описывают
как a-ТеО3; Н6ТеО6 легко раств. в горячей
воде и минер. к-тах (кроме НNO3); сильный окислитель, выделяет I2
из KI, окисляет НСl, НВr и др.; получают окислением ТеО2
пероксидом водорода в присут. H2SO4.
При нагр. a-ТеО3
с избытком воды в замкнутой ампуле при 350-400 °С образуется b-TeО3;
он менее реакционноспо-собен, чем a-ТеО3, не раств. в воде,
конц. к-тах и щелочах, не реагирует с водой при нагр. до 150°С; при нагр.
разлагается: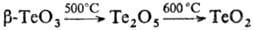 ;
диамагнитен. Получают при нагр. до 320 °С Н6ТеО6 в
присут. конц. H2SO4. Монокристаллы выращивают гидротермальным
синтезом. ТеО3-промежут. продукт при извлечении Те, при получении
теллуратов.
;
диамагнитен. Получают при нагр. до 320 °С Н6ТеО6 в
присут. конц. H2SO4. Монокристаллы выращивают гидротермальным
синтезом. ТеО3-промежут. продукт при извлечении Те, при получении
теллуратов.
Теллураты-соли ортотеллуровой
к-ты; кристаллы; соед. щелочных металлов раств. в воде; получают гидротермальным
синтезом, прокаливанием смеси Те с кислородсодержащей солью металла или смеси
Н6ТеОб с карбонатом металла; применяют как сегнетоэлектрики,
кристаллофос-форы (активированные U6+), ионоооменники в аналит. химии.
Фаза Те4О9
образуется при термич. разложении Н6ТеОв или a-ТеО3
при 420-500 °С, а также гидротермальным синтезом; при нагр. на воздухе до
520-600 °С превращ. в b-TeО2. Оксид Те2О5
получают при нагр. Н6ТеО6 на воздухе до 400-410 °С
или b-TeО3 при 500 °С, не раств. в воде, НСl,
HNО3; при 600 °С разлагается до ТеО2
и О2.
В. П. Зломанов.
|

