ТЕПЛОВАЯ ТЕОРЕМА
(третье
начало термодинамики), фундаментальное утверждение термодинамики, согласно к-рому
в любых изотермич. процессах, протекающих вблизи абс. нуля т-ры, изменения энтропии
системы не происходит, т. е. 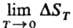 =
0. Энтропия конденсйр. фаз при Т:0 не зависит
от параметров состояния системы (давления, объема, напряженности магн. поля,
поверхностного натяжения на границе раздела фаз и т. п.). Т. т. не является
следствием первого и второго начал термодинамики, имеет многочисл. эксперим.
подтверждения и наз. третьим началом термодинамики. Впервые сформулирована В.
Нернстом в 1906.
=
0. Энтропия конденсйр. фаз при Т:0 не зависит
от параметров состояния системы (давления, объема, напряженности магн. поля,
поверхностного натяжения на границе раздела фаз и т. п.). Т. т. не является
следствием первого и второго начал термодинамики, имеет многочисл. эксперим.
подтверждения и наз. третьим началом термодинамики. Впервые сформулирована В.
Нернстом в 1906.
Важнейшими примерами соотношений,
устанавливаемыми Т. т., служат след. равенства:
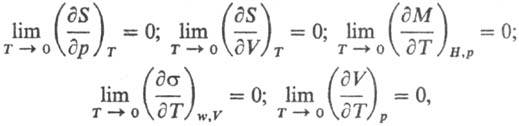
где S-
энтропия,
p и V-давление и объем фазы, М-общая намагниченность, H-напряженность
магн. поля, s-поверхностное натяжение фазы на границе раздела с газовой
(паровой) фазой, w-площадь пов-сти фазы. Т. обр., объем, намагниченность,
поверхностное натяжение, др. термодинамич. св-ва вблизи абс. нуля т-ры перестают
зависеть от т-ры. Т. т. подразумевает, кроме того, что для теплоемкостей в-ва
при постоянном давлении
Ср и при постоянном объеме CV выполняется
условие:
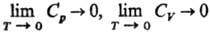
Важно, что эти утверждения
м. б. получены теоретически, на основе положений квантовой теории твердого тела.
Т. т. сформулирована для
конденсир. фаз, однако это не является существ. ограничением ее применимости,
т.к. при т-рах, близких к абс. нулю, все известные в природе в-ва находятся
при конечном давлении в конденсир. состоянии.
Из Т. т. следует утверждение
о принципиальной недостижимости абс. нуля т-ры в к.-л. реальном процессе перехода
с конечным числом операций. Существ. сложность представляют собой т.наз. замороженные
фазы-стекла, нек-рые мол. кристаллы (СО, NO, N2O и др.). Это неравновесное
состояние в-ва, сохраняющее ниже т-ры плавления структуру, присущую расплавам.
Энтропия замороженной фазы больше энтропии равновесной фазы того же состава
при той же т-ре, причем разница энтропии сохраняется вплоть до абс. нуля т-ры.
Однако поскольку переход равновесная фаза  замороженная фаза не относится к превращениям, происходящим между равновесными
фазами, противоречия с Т. т. не возникает. Утверждение о невозможности достижения
абс. нуля т-ры с помощью процессов, в к-рые вовлечены замороженные фазы, справедливо.
замороженная фаза не относится к превращениям, происходящим между равновесными
фазами, противоречия с Т. т. не возникает. Утверждение о невозможности достижения
абс. нуля т-ры с помощью процессов, в к-рые вовлечены замороженные фазы, справедливо.
Альтернативная формулировка
Т. т. предложена М. Планком (1911). Согласно этой формулировке, при абс. нуле
т-ры энтропия любой равновесной конденсир. фазы равна нулю при любых значениях
параметров состояния, т.е.
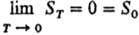 . Формулировка
Планка позволяет производить
расчеты абс. энтропии в-в в любом агрегатном состоянии. Так, для 1 моля газа
А абс. энтропияпри т-ре
T1 и давлении p определяется по ф-ле:
. Формулировка
Планка позволяет производить
расчеты абс. энтропии в-в в любом агрегатном состоянии. Так, для 1 моля газа
А абс. энтропияпри т-ре
T1 и давлении p определяется по ф-ле:
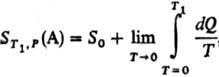
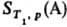
где S0
= 0-энтропия конденсир. в-ва А при абс. нуле т-ры, 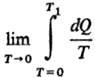 -теплота,
подведенная к системе
для нагревания до т-ры T1 и перевода в-ва А в газ,
к-рая м.б. измерена калориметрически.
-теплота,
подведенная к системе
для нагревания до т-ры T1 и перевода в-ва А в газ,
к-рая м.б. измерена калориметрически.
Абс. энтропии приводятся
в справочниках термодинамич. величин (см. Энтропия
). Знание абс.
энтропии помогает рассчитывать условия хим. равновесия (т. наз. метод абс. энтропии;
см. Константа равновесия
).
Формулировка Планка м.б.
проверена путем сравнения результатов калориметрич. измерений и статистич. расчетов
энтропии для газов. Для исследованных к настоящему времени в-в показано, что
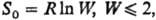
где R-газовая постоянная,
W-термодинамич. вероятность, равная числу микросостояний системы, реализующих
данное макросостояние (см. Статистическая термодинамика
).
Лит. см. при статьях Термодинамические потенциалы
, Химическая термодинамика. М. В. Коробов.
|

