АМИНОКИСЛОТЫ
, органические к-ты, содержащие одну или несколько
аминогрупп. В зависимости от природы кислотной ф-ции А. подразделяют на
аминокарбоновые, например H2N(CH2)5COOH,
аминосульфоновые, например H2N(CH2)2SO3H,
аминофосфоновые, например H2NCH[Р(О)(ОН)2]2,
и аминоарсиновые, например H2NC6H4AsO3H2.
Согласно правилам ИЮПАК, название
А. производят от названия соответствующей к-ты; взаимное расположение
в углеродной цепи карбоксильной и аминной групп обозначают обычно цифрами,
в нек-рых случаях - греч. буквами. Однако, как правило, пользуются тривиальными
названиями А.
Структура и физические свойства. По физ. и ряду хим. свойств
А. резко отличаются от соответствующих к-т и оснований (см. табл. 1 и 2).
Они лучше раств. в воде, чем в орг. р-рителях; хорошо кристаллизуются;
имеют высокую плотность и исключительно высокие т-ры плавления (часто разложения).
Эти св-ва указывают на взаимод. аминных и кислотных групп, вследствие чего
А. в твердом состоянии и в р-ре (в широком интервале рН) находятся в цвиттер-ионной
форме. Напр., для глицина кислотно-основное равновесие:
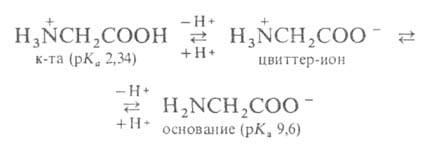
Взаимное влияние групп особенно ярко проявляется у аминокислот, где обе группы находятся в непосредств. близости, а также
у о- и n-аминобензойных к-т, где их взаимод. передается через
систему сопряженных связей. Благодаря электроноакцепторным св-вам группы
—
аминокислот, где обе группы находятся в непосредств. близости, а также
у о- и n-аминобензойных к-т, где их взаимод. передается через
систему сопряженных связей. Благодаря электроноакцепторным св-вам группы
— Н3
резко усиливается кислотность карбоксильных групп, напр. рКа глицина
2,34, тогда как уксусной к-ты 4,75,
Н3
резко усиливается кислотность карбоксильных групп, напр. рКа глицина
2,34, тогда как уксусной к-ты 4,75, аланина
3,6. Аминогруппа подвергается взаимокомпенсируемому влиянию электроноакцепторной
карбонильной группы и электронодонорного отрицательно заряженного атома
кислорода, в результате чего, напр., основность аминогрупп аминоуксусной
и n-аминобензойной к-т мало отличается от основности соотв. этиламина
и анилина. Аминогруппа А. ионизирована в несколько меньшей степени, чем
карбоксильная группа, и водный р-р А. имеет слабокислый характер. Значение
рН, при к-ром концентрация катионов А. равна концентрации анионов, наз.
изоэлектрич. точкой (рI). Все А. в изоэлектрич. точке имеют минимум
р-римости (в р-рах к-т и щелочей р-римость возрастает). Вблизи рI
р-ры А. обладают миним. буферным действием, а вблизи рК каждой функц.
группы-максимальным.
аланина
3,6. Аминогруппа подвергается взаимокомпенсируемому влиянию электроноакцепторной
карбонильной группы и электронодонорного отрицательно заряженного атома
кислорода, в результате чего, напр., основность аминогрупп аминоуксусной
и n-аминобензойной к-т мало отличается от основности соотв. этиламина
и анилина. Аминогруппа А. ионизирована в несколько меньшей степени, чем
карбоксильная группа, и водный р-р А. имеет слабокислый характер. Значение
рН, при к-ром концентрация катионов А. равна концентрации анионов, наз.
изоэлектрич. точкой (рI). Все А. в изоэлектрич. точке имеют минимум
р-римости (в р-рах к-т и щелочей р-римость возрастает). Вблизи рI
р-ры А. обладают миним. буферным действием, а вблизи рК каждой функц.
группы-максимальным.
Табл. 1 .- СВОЙСТВА L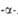 АМИНОКИСЛОТ
АМИНОКИСЛОТ
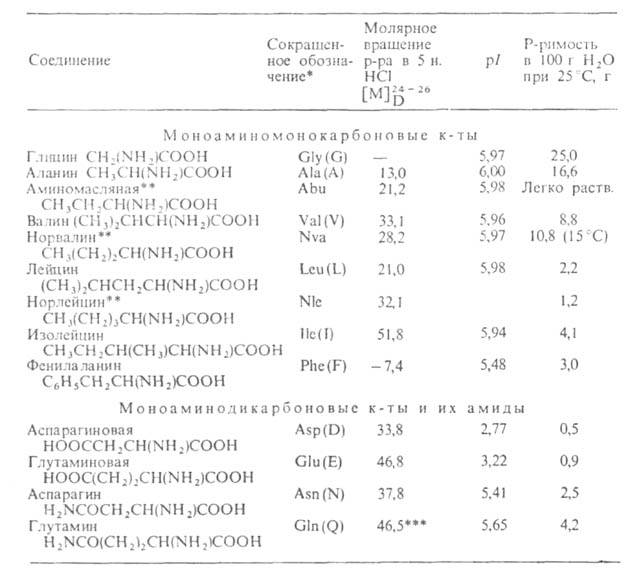
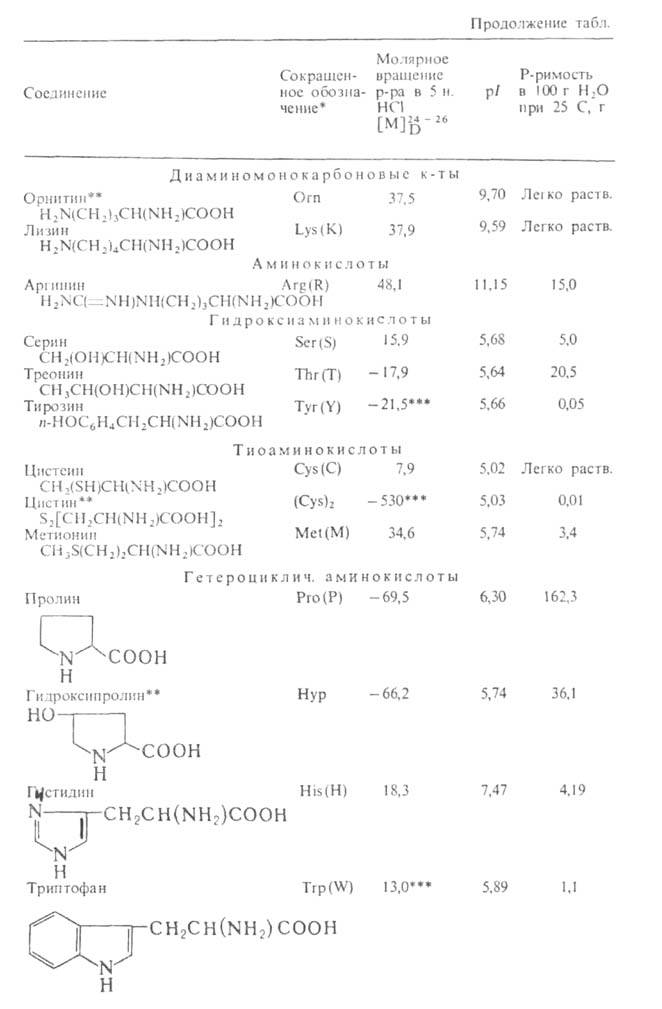
* В скобках дается однобукв. обозначение А., рекомендуемое ИЮПАК.
** Некодируемые А.к.: остальные кодируются генетич. кодом. *** Р-р в 1 н. НС1.
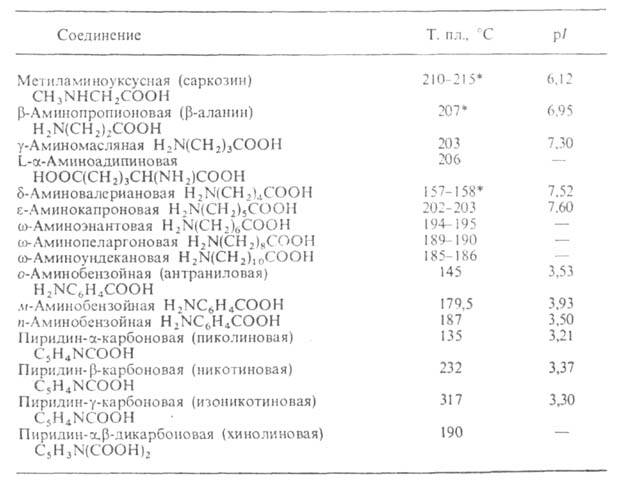
Табл. 2-СВОЙСТВА АМИНОКИСЛОТ

Цвиттер-ионная структура А. подтверждается их большим дипольным моментом
(не менее 50*10-30 Кл*м), а также полосой поглощения 1610-1550
см -1 в ИК-спектре твердой А. или ее р-ра.
Все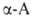 .,
кроме аминоуксусной (глицина), имеют асимметрии,
.,
кроме аминоуксусной (глицина), имеют асимметрии,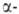 углеродный
атом и существуют в виде двух энантиомеров. За редким исключением прир.
углеродный
атом и существуют в виде двух энантиомеров. За редким исключением прир.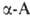 .
относятся к L-ряду (S-конфигурация) и имеют след. пространств. строение:
.
относятся к L-ряду (S-конфигурация) и имеют след. пространств. строение:
При переходе от нейтральных р-ров к кислым для А. L-ряда увеличивается
положит. вращение, для D-ряда-отрицательное. Гидроксипролин, треонин, изолейцин
имеют два асимметрич. атома и образуют по две пары диастереомеров. Оптич.
активность А. сильно зависит от длины волны поляризованного света (дисперсия
оптич. вращения). Как правило, А. более устойчивы к рацемизации, чем их
производные. Повышенной конфигурационной стабильностью отличаются N-бензилоксикарбонильные
производные А.
Расщепление рацематов А. на оптич. антиподы производят затравочной кристаллизацией
их солей с арилсулъфокислотами или кристаллизацией диастереомерных солей
ацильных производных А. с оптически активными основаниями или солей эфиров
А. с оптически активными к-тами. Часто используют энантиоселективный гидролиз
ацилами-нокислот ацилазами или гидролиз эфиров А. эстеразами, причем ферменты
атакуют в первую очередь L-A. Перспективно расщепление рацематов лигандообменной
хроматографией. Хроматографию используют также для анализа энантиомерного
состава А.
Химические свойства. Р-ции по карбоксильным группам А., аминогруппа
к-рых защищена ацилированием или солеобразованием, протекают аналогично
превращениям карбоновых к-т. А. легко образуют соли, сложные эфиры, амиды,
гидразиды, азиды, тиоэфиры, галогенангидриды, смешанные ангидриды и т.д.
Эфиры А. под действием натрия или магнийорг. соед. превращаются в аминоспирты.
При сухой перегонке в присут. Ва(ОН)2 А. декарбоксилируются.
Р-ции аминогрупп А. аналогичны превращениям аминов. А. образуют соли
с минер, к-тами и пикриновой к-той, легко ацилируются хлорангидридами к-т
в водно-щелочном р-ре (р-ция Шоттена - Баумана) и алкилируются алкилгалогенидами.
Метилиодид и диазометан превращают А. в бетаины . С формалином А. дают мегилольные или метиленовые производные, а в присут.
муравьиной к-ты или каталитически активированного Н2-N,N-диметиламинокислоты.
Под действием HNO2 ароматич. аминогруппы диазотируются, а алифатические
замещаются на гидроксил. При обработке эфиров А. изоцианатами и изотиоцианатами
образуются производные мочевины и тиомочевины. При нагр. с содой или при
одноврем. воздействии алкоголята и СО2 А. дают соли или эфиры
N-карбоксипроизводных А., а при использовании CS2-аналогичные
дитиокарбаматы.
. С формалином А. дают мегилольные или метиленовые производные, а в присут.
муравьиной к-ты или каталитически активированного Н2-N,N-диметиламинокислоты.
Под действием HNO2 ароматич. аминогруппы диазотируются, а алифатические
замещаются на гидроксил. При обработке эфиров А. изоцианатами и изотиоцианатами
образуются производные мочевины и тиомочевины. При нагр. с содой или при
одноврем. воздействии алкоголята и СО2 А. дают соли или эфиры
N-карбоксипроизводных А., а при использовании CS2-аналогичные
дитиокарбаматы.
Р-ции с одноврем. участием групп NH2 и СООН наиб. характерны
для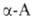 ., к-рые
способны образовывать устойчивые 5-членные гетероциклы. С ионами переходных
металлов (Си, Zn, Ni, Co, Pb, Ag, Hg, Cr)
., к-рые
способны образовывать устойчивые 5-членные гетероциклы. С ионами переходных
металлов (Си, Zn, Ni, Co, Pb, Ag, Hg, Cr)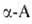 .
образуют прочные хелатные комплексы, что используется в комплексонах и
в комплексообразующих ионообменных смолах на основе аминокарбоновых и аминофосфоновых
к-т. При взаимод. с фосгеном
.
образуют прочные хелатные комплексы, что используется в комплексонах и
в комплексообразующих ионообменных смолах на основе аминокарбоновых и аминофосфоновых
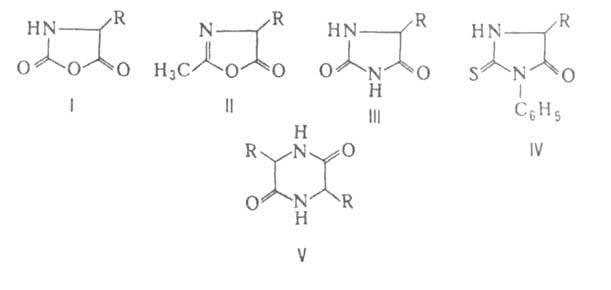
к-т. При взаимод. с фосгеном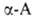 .
превращаются в циклич. ангидриды N-карбоксиаминокислот (ф-ла I), а при
нагр. с уксусным ангидридом или ацетилхлоридом - в азлактоны (II); нагревание
А. с мочевиной или обработка изоцианатами дает гидантоины (III), а при
использовании
.
превращаются в циклич. ангидриды N-карбоксиаминокислот (ф-ла I), а при
нагр. с уксусным ангидридом или ацетилхлоридом - в азлактоны (II); нагревание
А. с мочевиной или обработка изоцианатами дает гидантоины (III), а при
использовании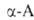 ., и особенно легко их эфиры, при нагр. превращаются в 2,5-пиперазиндионы,
или дикетопиперазины (V).
., и особенно легко их эфиры, при нагр. превращаются в 2,5-пиперазиндионы,
или дикетопиперазины (V).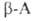 .
при нагр. дезаминируются и образуют
.
при нагр. дезаминируются и образуют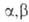 -ненасыщенные
к-ты,
-ненасыщенные
к-ты,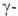 и
и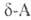 . отщепляют
воду и образуют 5- и 6-членные лактамы.
. отщепляют
воду и образуют 5- и 6-членные лактамы.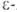 Аминокапроновая
к-та при нагр. образует в осн. полиамид и лишь частично превращ. в капролактам,
что характерно и для А. с большим числом метиленовых звеньев между функц.
группами. Бетаины
Аминокапроновая
к-та при нагр. образует в осн. полиамид и лишь частично превращ. в капролактам,
что характерно и для А. с большим числом метиленовых звеньев между функц.
группами. Бетаины .
при нагр. могут обратимо превращ. в эфиры диметиламинокислот, напр.:
.
при нагр. могут обратимо превращ. в эфиры диметиламинокислот, напр.: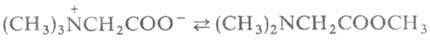 . При элиминировании триметиламина оетаины
. При элиминировании триметиламина оетаины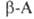 .
превращ. в ненасыщ. к-ты,
.
превращ. в ненасыщ. к-ты,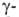 и
и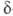 -бетаины-в
циклич. лактоны. При окислении
-бетаины-в
циклич. лактоны. При окислении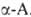 . образуют альдегиды с укороченной углеродной цепочкой. Из-за положит.
заряда на четвертичном атоме N бетаины не образуют солей со щелочами. По
аналогичной причине аминосульфоновые и аминофосфоновые к-ты не образуют
солей с к-тами.арилизотиоцианатовтиогидантоины (IV).
. образуют альдегиды с укороченной углеродной цепочкой. Из-за положит.
заряда на четвертичном атоме N бетаины не образуют солей со щелочами. По
аналогичной причине аминосульфоновые и аминофосфоновые к-ты не образуют
солей с к-тами.арилизотиоцианатовтиогидантоины (IV).
Анализ. Обычно анализ .
основан на взаимод. с нингидрином, в результате к-рого А. расщепляется
до альдегида, СО2 и NH3, a NH3 образует
с нингидрином фиолетовый краситель. Для количеств. определения измеряют
объем выделившегося СО2 или, чаще, фотометрируют образующийся
краситель. Последний метод используется в автоматич. хроматографах, позволяющих
разделять на сульфокатионитах и количественно анализировать сложные смеси
аминокислот и пептидов. Еще более чувствителен флуоресцентный анализ продуктов
реакции А. с о-фталевым диальдегидом. Быстро развивается лигандообменный
хроматографический анализ А. и пептидов на силикагельных сорбентах в присутствии
ионов меди. Бумажная и тонкослойная хроматография чаще используются для
качественного анализа. Измерение объема N2, выделяющегося при
дезаминировании А. азотистой к-той, а также титрование А. щелочью в избытке
формалина (методы Ван Слайка и Сёренсена [Серенсена]) сохранили лишь историческое значение.
.
основан на взаимод. с нингидрином, в результате к-рого А. расщепляется
до альдегида, СО2 и NH3, a NH3 образует
с нингидрином фиолетовый краситель. Для количеств. определения измеряют
объем выделившегося СО2 или, чаще, фотометрируют образующийся
краситель. Последний метод используется в автоматич. хроматографах, позволяющих
разделять на сульфокатионитах и количественно анализировать сложные смеси
аминокислот и пептидов. Еще более чувствителен флуоресцентный анализ продуктов
реакции А. с о-фталевым диальдегидом. Быстро развивается лигандообменный
хроматографический анализ А. и пептидов на силикагельных сорбентах в присутствии
ионов меди. Бумажная и тонкослойная хроматография чаще используются для
качественного анализа. Измерение объема N2, выделяющегося при
дезаминировании А. азотистой к-той, а также титрование А. щелочью в избытке
формалина (методы Ван Слайка и Сёренсена [Серенсена]) сохранили лишь историческое значение.
Получение. .
получают галогенированием карбоновых к-т или эфиров в
.
получают галогенированием карбоновых к-т или эфиров в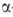 -положение
с послед. заменой галогена на аминогруппу при обработке амином, аммиаком
или фталимидом калия (по Габриелю).
-положение
с послед. заменой галогена на аминогруппу при обработке амином, аммиаком
или фталимидом калия (по Габриелю).
По Штреккеру - Зелинскому .
получают из альдегидов:
.
получают из альдегидов:
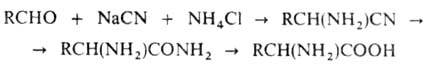
Этот метод позволяет также получать нитрилы и амиды соответствующих .
По сходному механизму протекает образование
.
По сходному механизму протекает образование -аминофосфоновых
к-т по р-ции Кабачника-Филдса, напр.:
-аминофосфоновых
к-т по р-ции Кабачника-Филдса, напр.:
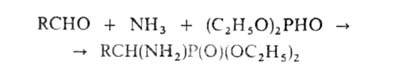
В этой р-ции вместо альдегидов м. б. использованы кетоны, а вместо диалкилфосфитов
- диалкилтиофосфиты, кислые эфиры алкил(арил)фосфонистых к-т RP(OH)OR и
диарилфосфиноксиды Аr2НРО. Таким путем получен широкий набор
комплексонов.
Альдегиды и кетоны или их более активные производные - кетзли служат
исходными соед. для синтеза А.
с увеличением числа углеродных атомов на две единицы. Для этого их конденсируют
с циклич. производными аминоуксусной к-ты - азалакгонами, гидантоинами,
тиогидантоинами, 2,5-пиперазиндионами или с ее медными или кобальтовыми
хелатами, напр.:
А.
с увеличением числа углеродных атомов на две единицы. Для этого их конденсируют
с циклич. производными аминоуксусной к-ты - азалакгонами, гидантоинами,
тиогидантоинами, 2,5-пиперазиндионами или с ее медными или кобальтовыми
хелатами, напр.:
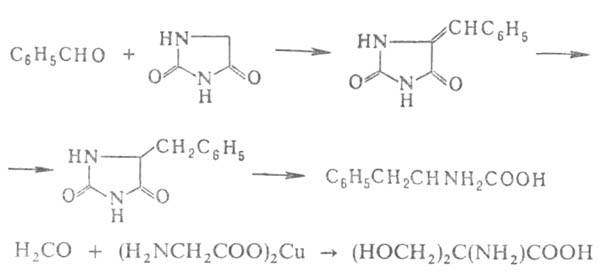
Удобные предшественники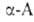 .-аминомалоновый
эфир и нитроуксусный эфир. К их
.-аминомалоновый
эфир и нитроуксусный эфир. К их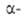 углеродным
атомам можно предварительно ввести желаемые радикалы методами алкилирования
или конденсации.
углеродным
атомам можно предварительно ввести желаемые радикалы методами алкилирования
или конденсации.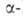 Кетокислоты
превращ. в
Кетокислоты
превращ. в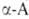 .
гидрированием в присут. NH3 или гидрированием их оксимов или
гидразонов.
.
гидрированием в присут. NH3 или гидрированием их оксимов или
гидразонов.
Нек-рые L А.
ввиду сложности синтеза и разделения оптич. изомеров получают микробиол.
способом (лизин, триптофан, треонин) или выделяют из гидролизатов прир.
белковых продуктов (пролин, цистин, аргинин, гистидин). Перспективны смешанные
химически-ферментативные способы синтеза, напр.:
А.
ввиду сложности синтеза и разделения оптич. изомеров получают микробиол.
способом (лизин, триптофан, треонин) или выделяют из гидролизатов прир.
белковых продуктов (пролин, цистин, аргинин, гистидин). Перспективны смешанные
химически-ферментативные способы синтеза, напр.:
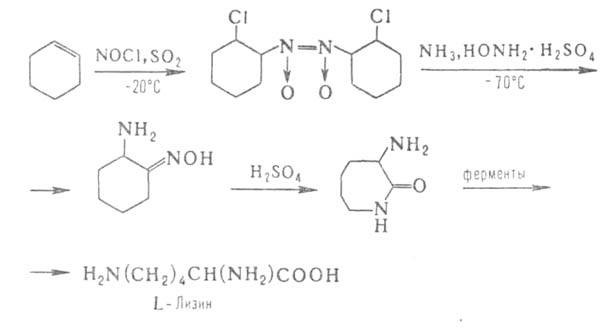
 Аминосульфоновые
к-ты получают при обработке аммиаком продуктов присоединения NaHSO3
к альдегидам:
Аминосульфоновые
к-ты получают при обработке аммиаком продуктов присоединения NaHSO3
к альдегидам:
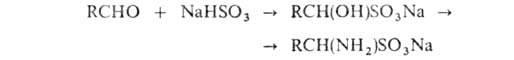
 . синтезируют
присоединением NH3 или аминов к
. синтезируют
присоединением NH3 или аминов к ненасыщенным к-там, а также по методу Родионова - конденсацией альдегидов
с малоновой к-той в присут. NH3:
ненасыщенным к-там, а также по методу Родионова - конденсацией альдегидов
с малоновой к-той в присут. NH3:
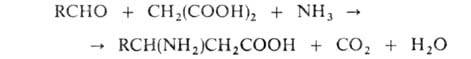
 . получают
гидролизом соответствующих лактамов (напр.,
. получают
гидролизом соответствующих лактамов (напр., капролактама),
к-рые образуются в результате перегруппировки Бекмана из оксимов циклич.
кетонов под действием H2SO4.
капролактама),
к-рые образуются в результате перегруппировки Бекмана из оксимов циклич.
кетонов под действием H2SO4. Аминоэнантовую,
Аминоэнантовую, аминопеларгоновую
и
аминопеларгоновую
и аминоундекановую
к-ты синтезируют из
аминоундекановую
к-ты синтезируют из тетрахлоралканов путем их гидролиза конц. H2SO4 до
тетрахлоралканов путем их гидролиза конц. H2SO4 до хлоралкановых к-т с послед. аммонолизом:
хлоралкановых к-т с послед. аммонолизом:
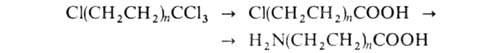
Исходные тетрахлоралканы получают теломеризациеи этилена с СС14.
Ароматич. А. синтезируют восстановлением нитробензойных к-т или окислением
толуидинов после предварит. бензоилирования аминогруппы. Антраниловую к-ту
получают из фталевого ангидрида:
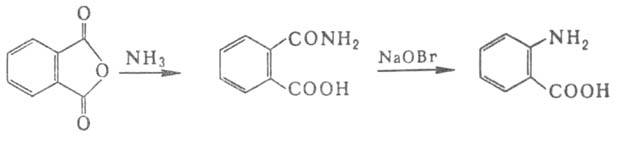
Для синтеза .,
меченных изотопами 15N и 14С, обычно пользуются методами
Габриеля и Штреккера соответственно. Меченные 3Н А. получают
из ненасыщ. предшественников.
.,
меченных изотопами 15N и 14С, обычно пользуются методами
Габриеля и Штреккера соответственно. Меченные 3Н А. получают
из ненасыщ. предшественников.
Сульфаниловая к-та образуется при нагр. сульфата анилина до 180°С. Ее
мета-изомер получают
сульфированием нитробензола с послед. восстановлением нитрогруппы.
Применение. Наиб. интерес представляют 20 L А.
(аланин, аргинин, аспарагин и др.), входящих в состав белковых молекул.
Смеси L-A., а также индивидуальные А. (напр., метионин
)применяют
в медицине для парэнтерального питания больных с заболеваниями пищеварит.
и др. органов, при нарушениях обмена в-в и др.; лизин
, метионин,
треонин
,
триптофан - в животноводстве для обогащения кормов; глутамат натрия
и лизин - в пищ. пром-сти.
А.
(аланин, аргинин, аспарагин и др.), входящих в состав белковых молекул.
Смеси L-A., а также индивидуальные А. (напр., метионин
)применяют
в медицине для парэнтерального питания больных с заболеваниями пищеварит.
и др. органов, при нарушениях обмена в-в и др.; лизин
, метионин,
треонин
,
триптофан - в животноводстве для обогащения кормов; глутамат натрия
и лизин - в пищ. пром-сти. .
и их лактамы служат для пром. произ-ва полиамидов.
.
и их лактамы служат для пром. произ-ва полиамидов.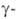 Аминомасляная
к-та (аминалон) - медиатор в центр. нервной системе, применяется как лек.
ср-во при сосудистых заболеваниях головного мозга. Ароматич. А. используют
в синтезе красителей и лек. ср-в. На основе аминокарбоновых и аминофосфоновых
к-т синтезируют селективные комплексоны, комплексообразующие иониты, лигандообменные
сорбенты, ПАВ.
Аминомасляная
к-та (аминалон) - медиатор в центр. нервной системе, применяется как лек.
ср-во при сосудистых заболеваниях головного мозга. Ароматич. А. используют
в синтезе красителей и лек. ср-в. На основе аминокарбоновых и аминофосфоновых
к-т синтезируют селективные комплексоны, комплексообразующие иониты, лигандообменные
сорбенты, ПАВ.
Лит.: Гринштейн Дж., ВиницМ., Химия аминокислот и пептидов, пер.
с англ., [М.], 1965; Шредер Э., Любке К., Пептиды, пер. с англ., т. 1-2,
М., 1967-69; Кабачник М.И. [и др.], "Успехи химии", 1968, т. 37, в. 7,
с. 1161-91; Химия полипептидов, пер. с англ., М., 1977. См. также лит
.
при ст. Белки
. В. А. Даванков.

