ТЕТРАЦИАНОЭТИЛЕН
(NC)2C=C(CN)2, мол. м. 128,09; бесцв. кристаллы моноклинной
сингонии (а = 0,751 нм, b = 0,621 нм, с = 0,700 нм, b
= 97,17°, z = 2, пространств. группа P21/n);
т. пл. 201-202 °С (в запаянном капилляре), т. кип. 223 °С, при т-ре
выше 120°С возгоняется; плота. 1,318 г/см3; 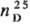 1,560; ур-ние температурной зависимости давления пара: lgp (мм рт. ст.)
= 11,67 — 4250/Т;
1,560; ур-ние температурной зависимости давления пара: lgp (мм рт. ст.)
= 11,67 — 4250/Т;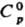 0,849 кДж/(кг · К); DHвозг 81,2 кДж/моль,
DH0сгор - 2,98 кДж/моль,
0,849 кДж/(кг · К); DHвозг 81,2 кДж/моль,
DH0сгор - 2,98 кДж/моль, 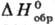 - 623,8 кДж/моль; e 2,93-3,60.
- 623,8 кДж/моль; e 2,93-3,60.
Практически не раств. в
воде, раств. во многих орг. р-рителях. Термически стабилен до 600 °С; при
800 °С распадается на дициан (CN)2 и дицианоацетилен NCC==CCN.
С донорами электронов (циклогексен, пиридин, а также бензол, нафталин, флуорен,
пирен и др. арены) образует интенсивно окрашенные комплексы с переносом заряда,
в к-рых выступает в роли к-ты Льюиса.
Т. вступает в р-ции циклоприсоединения
(р-цию с 1,3-диенами часто используют для характеристики последних, в т.ч. нестабильных
и трудно выделяемых), напр.:
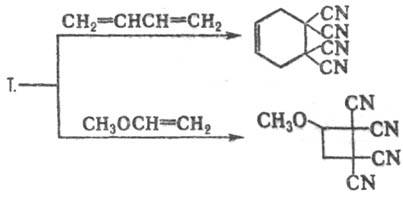
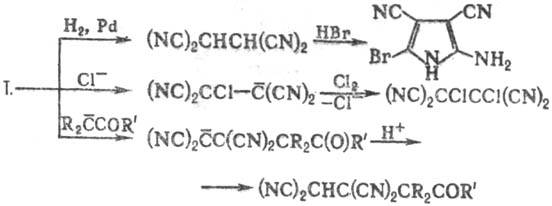
Т. восстанавливается до
1,1,2,2-тетрацианоэтана, из к-рого далее м. б. получены гетероциклич. соед.;
легко вступает в р-ции с разл. нуклеофилами, напр.:
Для Т. характерны р-ции
замещения одной или двух цианогрупп на ОН, OR, амино, арил и др., напр.:
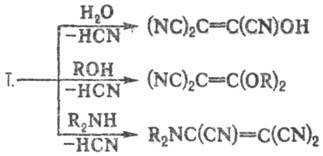
Продукт гидролиза Т. трицианоэтенол-сильная
к-та, выделена лишь в виде солей.
При взаимодействии Т. с
Н2О2 образуется кристаллич. оксиран. В присут. металлов,
металлокомплексов, спиртов, фенолов, аминов или ароматич. соед. при 160-180
°С Т. полимеризуется (в отличие от акрилонитрила полимеризация протекает
по группе C=N); полимеры обладают св-вами полупроводников и каталитич.
св-вами.
Получают Т. из малонодинитрила:
2СН2 (CN)2 + + 2S2Cl2 : Т.
+ 4НСl + 4S; из дихлорфумародинитрила: NCC(Cl)=C(Cl)CN + 2HCN :T. Для
получения Т. в больших масштабах м. б. использован синтез из тетрациано-1,4-дитиина:
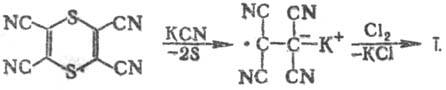
В лаборатории Т. получают
из малонодинитрила по р-ции:
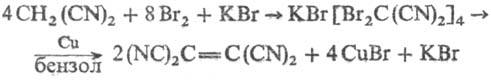
Используют Т. в качестве
полупродукта в орг. синтезе И при получении лек. в-в. По токсичности Т. близок
к KCN.
Лит.: Физер Л.,
Физер М., Реагенты для органического синтеза, пер. с англ., т. 3, М., 1970,
с. 314-18; Gmelins Handbuch der anorganischen Chemie, 8 Aufl., Bd 14, Tl Dl,
В., 1974, S. 107-15; Kirk-Othmer encyclopedia, 3 ed., v. 6, N. Y., 1978, p.
625-33. С. К. Смирнов.
|

