ТИОУКСУСНАЯ КИСЛОТА
CH3C(O)SH, мол. м. 76,12; желтая жидкость; т. шт.
-17°С, т. кип. 93 °С; 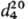 1,068;
1,068; 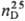 1,4630; рКа
3,33 (вода, 25 °С); раств. в этаноле, диэтило-вом эфире; медленно разлагается
водой с выделением H2S. Относительно стабильна, начинает разлагаться
при т-ре выше 120°С; при нагр. с ZnCl2 диспропорционирует на
уксусную и дитиоуксусную к-ты.
1,4630; рКа
3,33 (вода, 25 °С); раств. в этаноле, диэтило-вом эфире; медленно разлагается
водой с выделением H2S. Относительно стабильна, начинает разлагаться
при т-ре выше 120°С; при нагр. с ZnCl2 диспропорционирует на
уксусную и дитиоуксусную к-ты.
Т.к. образует соли; нагревание
Pb-соли до ~150°С приводит к тиоангидриду (ацетилсульфиду) (CH3CO)2S,
последний м.б. получен также обработкой ацетилхлори-да K2S.
При взаимодействии Т.к.
с альдегидами образуются ди(тиоацетаты) RCH(SCOCH3)2,
с ароматич. аминами и изотиоцианатами - замещенные ацетамиды, напр.:
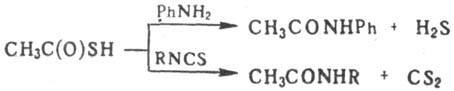
Т.к. вступает в р-ции радикального
присоединения к оле-финам (против правила Марковникова) и алкинам; р-ция используется
в орг. синтезе, напр. при получении алкан-сульфокислот:
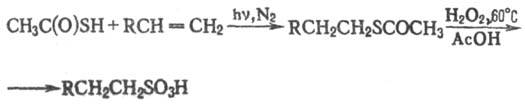
Т.к. существует в виде
равновесной смеси тиол- и тион-уксусной к-т: CH3C(O)SH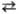 CH3C(S)OH
с преобладанием тиольной формы. Сложные эфиры Т.к. известны 2 типов: S-эфиры
CH3C(O)SR и О-эфиры CH3QS)OR; т-ры кипения О-эфиров немного
ниже, чем для соответствующих S-эфи-ров. Эфиры Т.к. не м.б. получены прямой
этерификацией к-ты спиртами из-за образования смеси S-эфира и соответствующего
ацетата (исключение -этерификация трифе-нилкарбинола с образованием S-эфира).
S-Эфиры получают: присоединением Т.к. к олефинам; взаимод. солей Т.к. с ал-килгалогенидами
(р-ция 1); ацилированием тиолов ацетил-хлоридом (2); р-цией Т.к. с тиоцианатами
с образованием дитиоуретанов и последующим отщеплением HSCN (3); взаимод. кетена
с тиолами при — 80 °С (4); разложением иминотиоэфиров (5):
CH3C(S)OH
с преобладанием тиольной формы. Сложные эфиры Т.к. известны 2 типов: S-эфиры
CH3C(O)SR и О-эфиры CH3QS)OR; т-ры кипения О-эфиров немного
ниже, чем для соответствующих S-эфи-ров. Эфиры Т.к. не м.б. получены прямой
этерификацией к-ты спиртами из-за образования смеси S-эфира и соответствующего
ацетата (исключение -этерификация трифе-нилкарбинола с образованием S-эфира).
S-Эфиры получают: присоединением Т.к. к олефинам; взаимод. солей Т.к. с ал-килгалогенидами
(р-ция 1); ацилированием тиолов ацетил-хлоридом (2); р-цией Т.к. с тиоцианатами
с образованием дитиоуретанов и последующим отщеплением HSCN (3); взаимод. кетена
с тиолами при — 80 °С (4); разложением иминотиоэфиров (5):
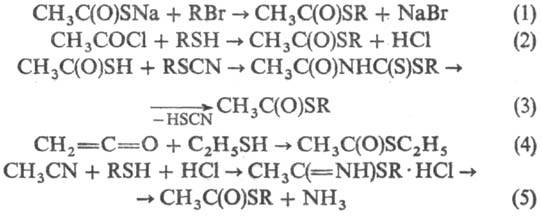
О-Эфиры получают действием
H2S на иминоэфиры или взаимод. хлортиоформиатов с реактивами Гриньяра:
CH3C(=NH)OR
+ H2S : CH3C(S)OR + NH3 ClC(S)OC2H5
+ CH3MgI : CH3C(S)OC2H5 +
MgICl
Наиб. удобный способ получения
Т.к.-обработка уксусного ангидрида H2S в присут. небольшого кол-ва
твердой щелочи:
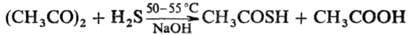
Т.к. получают также действием
P2S5 на СН3СООН или р-цией СН3СОСl
с H2S.
Применяют Т.к. в качестве
заменителя H2S в аналит. химии; Mg-соль Т.к.-антидот при отравлениях
ртутью, S-этиловый эфир-ингибитор коррозии.
В орг. синтезе Т.к. используют
для модификации a,b-не-насыщ. 3-кетостероидов, S-ацетилирования кофермента
А и пантетина.
Т. воспл. 11 °С; обладает
слезоточивым действием, токсична, ЛД50 0,125 мг/кг (мыши, перорально).
Лит.: Reid E.
E., в сб.: Organic chemistry of bivalent sulfur, v. 4, N. Y., 1962, p.
11-37; Физер Л., Физер М., Реагенты для органического синтеза, пер. с англ.,
т. 3, М., 1970, с. 336-40. А. А. Дудинов.
|

