ТИОФЕНОЛЫ
(арентиолы,
ароматич. тиолы) ArSH, где Ar-фенил, нафтил (в т.ч. замещенные) и др. Жидкие
или кристаллич. в-ва; плохо раств. в воде, раств. в орг. р-рите-лях. Т.-более
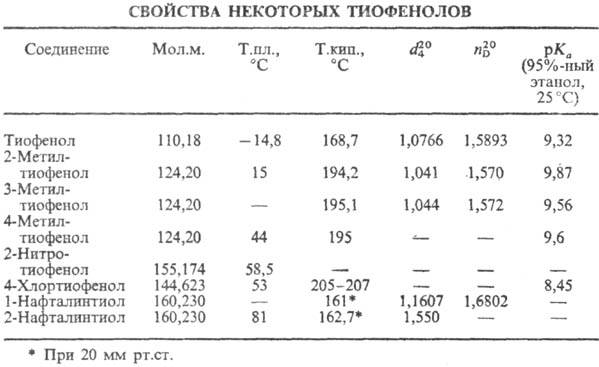
сильные к-ты, чем фенолы (см. табл.).
В ИК спектрах Т. характеристич.
полосы поглощения группы SH лежат в области 2500-3000 см-1. В
УФ спектрах присутствуют 2 полосы, напр. для C6H5SH lмакс240
и 270 нм, e ~ 105 и ~700 соотв. (p : p*-переходы).
В спектре ПМР хим. сдвиг (d) протона группы SH-в области 3-4 м.д. (СCl4).
В разб. р-рах Т. находятся
в мономерной форме, в конц. р-рах ассоциируются благодаря межмол. или внутримол.
водородным связям.
Т. обладают всеми хим.
св-вами, характерными для тиолов
.
Получают Т. обычно косвенными
методами с использованием металлоорг. соединений., напр.:
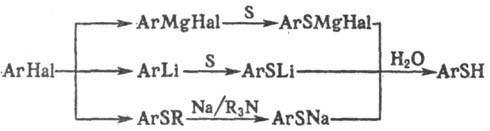
Т. образуются из первичных
ароматич. аминов через соответствующие диазониевые соли, напр.:
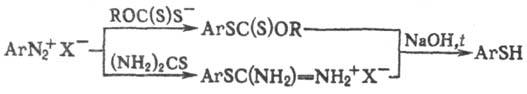
Используют также р-ции
диазониевых солей с Na2Sx (x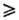 2)
с образованием ArSxAr либо с (CuSCN)2 с образованием
ArSCN с послед, восстановлением Zn в СН3СООН, NaBH4 или
LiAlH4.
2)
с образованием ArSxAr либо с (CuSCN)2 с образованием
ArSCN с послед, восстановлением Zn в СН3СООН, NaBH4 или
LiAlH4.
Т. могут быть получены
из фенолов; последние переводят в О-арилтиокарбаматы либо эфиры тиолкарбоновых
к-т и далее подвергают
термич. перегруппировке (см. Ньюмена-Кворта реакция
) и гидролизу,
напр.:
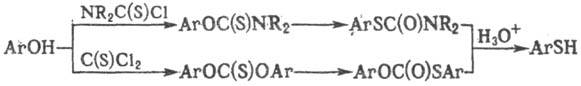
Разработан способ получения
Т. р-цией хлораренов с H2S или алкантиолами в газовой фазе:
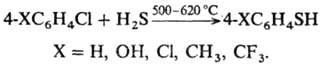
Для получения Т. используют
также р-цию ароматич. углеводородов с серосодержащими электрофилами (только
для соед. с электронодонорными заместителями; ур-ние 1); восстановление дисульфидов
(2, восстановители-LiAlH4, NaBH4, глюкоза, Zn в СН3СООН,
РРh3 в СН3ОН); взаимод. галогенаренов с CH3SNa
в гексаметаполе (3):
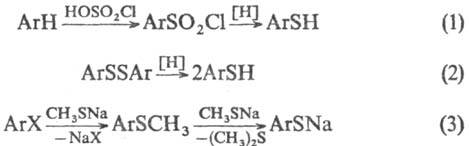
X = Сl, Вr; Аr = Ph, нафтил
и др.
Применяют Т. в синтезе
лек. препаратов, пестицидов, полимеров и др.
Лит. см. при ст.
Тиолы
. Э. Н. Дерягина.
|

