ТИОФОСФАТЫ ОРГАНИЧЕСКИЕ
,
соед. общей ф-лы ХnY3-nР=2, где X = OR или
SR, Y = ОН или SH, Z = О или S, R-opг. радикал, n=1-3 (молекула
содержит не менее одного атома S, связанного с атомом Р); Т.о. наз. также соли
соответствующих к-т (при n < 3).
Подразделяют Т.о. на полные
(третичные, или средние, n = 3) и кислые (первичные n = 1, вторичные
n —
2). Название Т.о. включает назв. радикалов (через дефис приводят
символ связанного с P гетероатома) и назв. тио- фосфатного остатка, иногда
Т.о. наз. как эфир
тиокислоты фосфора [напр., CH3O(C4H9S)P(S)OH-О-метил-S-бутилдитиофосфат,
или О-метиловый S-бутиловый эфир дитиофосфорной к-ты].
Полные Т.о. Соед. с низшими
алифатич., смешанными алифатич. и ароматич. радикалами, как правило подвижные
жидкости (реже-масла), остальные-кристаллич. в-ва (см. табл.). Соед.. с относительно
небольшой мол. массой перегоняются в вакууме; большинство полных Т.о. раств.
в орг. р-рителях, низшие члены ряда ограниченно раств. в воде.
Конфигурация молекул эфиров-тетраэдрическая.
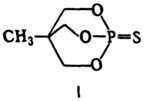
Величины дипольных моментов находятся обычно в пределах 7,67·10-30-1,07·10-29
Кл·м; исключение-нек-рые би-циклотионфосфаты (напр., для соед. ф-лы I m
2,235 x x 10-29 Кл·м) и арилзамещенные тионфосфаты [напр.,
для C2H5O(n-O2NC6H4O)2PS
m 1,635·10-29 Кл·м].
В ИК спектрах полоса поглощения
связи P=S (низкой характеристичности) находится в области 650-700 см-1.
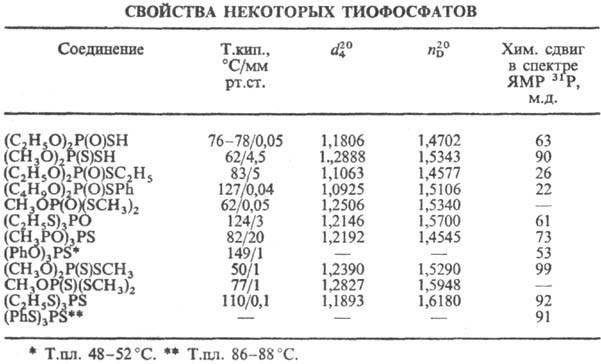
В спектрах ЯМР31Р хим. сдвиги (м.д.) для соед. типа (RO)3PS-
50-85, для (RO)2P(S)SR-90-100, для (RO)2P(O)SR-13-40.
Полные Т.о. образуют комплексы
с солями мн. металлов; комплексы тиофосфорильных соед. (содержат тиофосфо-рильную
группу P=S) с солями тяжелых металлов менее стабильны, чем подобные комплексы
полных фосфатов. Тиофосфорильные соед. сравнительно легко (напр., при действии
Na) восстанавливаются до полных эфиров к-т трехвалентного Р; при действии Н2О2,
HNO3 или др. окислителей (иногда Н2О) превращ. в фосфорильные
соед. (содержат фосфорильную группу Р=О); при действии Сl2 или SО2Сl2-в
фосфорилсульфенхлориды (RO)3P(O)SCl.
Соед. типа (RO)3P(S)OR
(тионфосфаты) склонны к изомеризации в тиолфосфаты (RO)3P(O)SR (см. Пищиму-ки реакция). Продукты S-алкилирования образуются также
при действии RHal на тиофосфорильные соед., напр.:
(RO)3P(S) +
RHal : (RO)2P(O)SR + RHal
По эфирному атому S реагируют
нек-рые электрофилы, напр.:
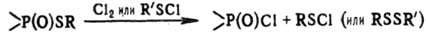
Полные Т.о. с низшими алифатич.
радикалами алки-лируют NR3, R2S, (NH2)2C(S)
и нек-рые др. орг. основания; при этом тионфосфаты, содержащие хотя бы одну
группу RO, претерпевают тион-тиольную перегруппировку, напр.:
(CH3O)3PS
+ (CH3)2NR ::
[(СН3O) (CH3S)P(O)O]-[(CH3)3NR]+
(CH3O)2P(S)SCH3 + (CH3)2S
: [(СН3S)2Р(O)О]- [(СН3)3S]+
Соед. сравнительно устойчивы
к гидролизу в нейтральных средах и, как правило, быстро разлагаются (с выделением
H2S) в
кислых средах. В щелочных средах гидролиз чаще всего приводит к образовадию
солей кислых Т.о. При гидролизе и алкоголизе полных Т.о., содержащих одновременно
группы RO и RS, обычно в первую очередь отщепляется группа RS. В остальном полные
Т.о. близки по своим св-вам к полным фосфатам (см. Фосфаты органические
).
Обычно полные Т.о. получают
взаимод. РОСl3 или PSCl3 со спиртами, фенолами и тиолами
(или их Na-производны-ми) в присут. орг. оснований. Соед. с тиофосфорильной
группой можно также получать присоединением S к тио-фосфитам (RO)nP(SR)3-n
или нагреванием триорганилфос-фатов с P2Sc (в случае алкилфосфатов
возможно образование S-алкилфосфатов в результате тион-тиольной перегруппировки).
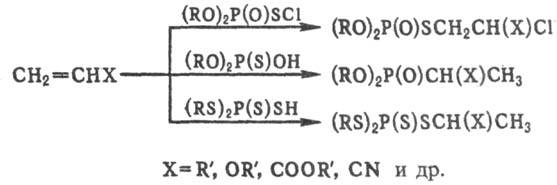
Полные Т.о. с разнообразными
S-алкильными радикалами м.б. получены присоединением фосфорилсульфенхло-ридов,
а также кислых Т.о. к соед. с кратными связями, напр.:
Т.о. типа (RO)2P(O)SR
в лаб. условиях часто получают взаимод. вторичных или третичных фосфитов с RSX
(X = С1, CN, R2N, SR). Общий метод синтеза тетратиофосфа-тов основан
на взаимод. P2S5 с тиолами, простыми эфирами, полными
боратами, алкоксисиланами или спиртами.
Кислые Т.о. Наиб. полно
изучены вторичные тио- и ди-тиофосфаты (RO)2P(S)OH и (RO)2P(S)SH.
Остальные типы вторичных тиофосфатов, обладающие сравнительно низкой устойчивостью,
в индивидуальном состоянии не охарактеризованы (достаточно подробно изучены
только их соли). Еще меньшей устойчивостью обладают первичные тиофос-фаты [напр.,
дитиофосфаты типа RSP(S)(OH)2 разлагаются уже на холоду, а их соли-при
нормальных условиях]; охарактеризованы и используются в синтезах только соли
первичных тиофосфатов с анионами ROP(O)(OH)S- и RSP(O)(OH)O-.
Вторичные тиофосфаты с
R = Alk обычно жидкости, перегоняющиеся в вакууме; остальные-кристаллич. в-ва;
раств. в орг. р-рителях, низшие-в воде. Монотиофосфаты (RO)2P(S)OH
в водных р-рах существуют преим. в тиольной форме; в чистом виде и спиртовых
р-рах-в тионной. В анионах солей [(RO)2P(O)S]-M+
(М = NH4, NR3H, Na, К) отри-цат. заряд распределен
между атомами S, P и фосфо-рильным атомом О.
Вторичные тиофосфаты-к-ты
средней силы; напр., рКа в водном этаноле (7 и 80%-ный С2Н5ОН)
для (CH3O)2P(S)OH соотв. 1,18 и 2,5; для (изо
-С3Н7О)2Р(S)ОН-1,59
и 2,9; для (изо
-C3H7O)2P(S)SH-l,82 и
2,65; для (C4H9O)2P(S)SH-1,83 и 2,64.
В ИК спектрах полосы поглощения
связи P=S 600-660 см-1, связи Р—SH (в ССl4) ок. 2540 см-1.
В спектрах ЯМР 31Р хим. сдвиги (м.д.) для соед. типа (RO)2P(S)OH-45-71,
для (RO)2P(S)SH-80-90 м.д.
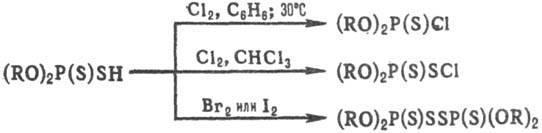
Кислые Т.о. образуют соли
с NH3 и аминами, с гидрокси-дами и оксидами металлов. При действии
На12 (Сl, Вr, I) вторичные тиофосфаты в зависимости от условий образуют
след. соединения:
Алкилированные по атому
S продукты образуются при действии на О,О-диалкилтиофосфаты RHal,
соед. с кратными связями, триалкиловых эфиров ортомуравьиной к-ты, эпоксидов
и др., напр.:
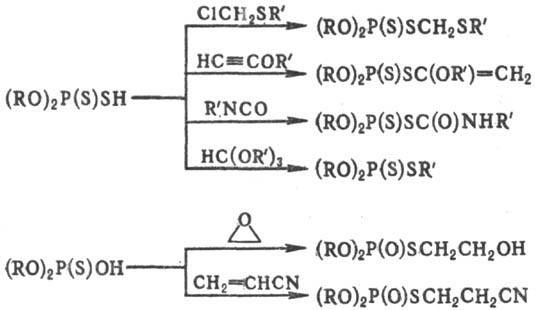
О,О-Диорганилтиофосфаты
обычно получают присоединением S к диорганилфосфитам. Эти соед. с хорошим выходом
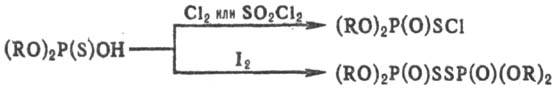
образуются также при гидролизе хлорангидридов эфиров тиофосфорных к-т (RO)2P(S)C1
и путем ацидолиза полных тионфосфатов (RO)3P(S). Наиб. используемый
в пром-сти метод синтеза О,О-диорганилдитиофосфатов основан на р-ции
спиртов или фенолов с P2S5. Высшие О,О-диалкилдитиофосфаты
и олигомеры на их основе получают путем переэтерификации:
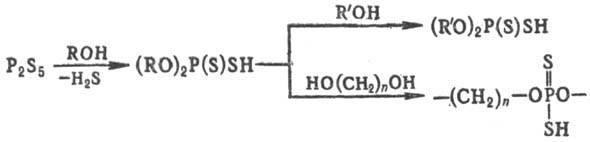
В лабораторных условиях
О,О-диалкилдитиофосфаты получают также алкоголизом органилтритиометафосфа-тов
RSPS2.
Среди полных Т.о. встречаются
соед. с относительно высокой токсичностью для теплокровных. Так, для О,О-ди-этил-S-(2-диэтиламино)этилтиофосфата
(амитон, или те-трам) и его иодэтилата ЛД50 (мыши, внутрибрюшинно)
соотв. 0,5 и 0,17 мг/кг.
Представители полных Т.о.
составляют наиб. многочисл. группу фосфорорг. пестицидов
; Т.о. используют
также в качестве противоизносных и антикоррозионных присадок к смазочным маслам,
пластификаторов полимерных материалов, флотац. агентов и дефолиантов.
Лит.: Нифантьев
Э. Е., Химия фосфорорганических соединений, М., 1971, с. 171-97; Fest С., Schmidt
K.-J., The Chemistry of organophosphorus pesticides, В., 1973; Ailman D., Mages
R, в кн.: Organic phosphorus compounds, v. 7, N.Y., 1976, p. 487-865. Г.И.
Дрозд.
|

