ТРАНСПОРТНЫЕ РИБОНУКЛЕИНОВЫЕ КИСЛОТЫ
(тРНК, трансферные
РНК, адапторные РНК), низкомолекулярные РНК, осуществляющие перенос аминокислотных
остатков к матричной РНК (мРНК) при трансляции
(синтезе полипептидяой
цепи на мРНК-матрице в рибосомах).
Присутствуют в цитоплазме
и митохондриях. Цитоплаз-матич. тРНК состоят из одной полирибонуклеотидной цепи,
включающей 74-95 нуклеотидных
остатков (мол. м. 24-31 тыс.), митохондриальные тРНК немного короче. Для всех
молекул тРНК характерно присутствие остатка фосфорной к-ты на 5-конце (см. Нуклеиновые кислоты
) нуклеотидной цепи (фосфорилирован 5-гидроксил),
наличие последовательности ССА—ОН (С-остаток цитидина, А-аденозина) на 3-конце
и неск. консервативных нуклеотидных остатков, рассеянных вдоль цепи и занимающих
во всех тРНК одни и те же положения.
Отличит. особенность тРНК-присутствие
в молекуле минорных нуклеозидов (миноров), общее число разновидностей к-рых
в разных тРНК св. 50, а в одной молекуле тРНК их доля может достигать 25%. Они
образуются путем метилирования, гидрирования и др. превращений обычных нуклеотидных
звеньев в ходе посттранскрипц. модификации тРНК под действием соответствующих
ферментов. Большинство миноров влияет на стабильность пространственной структуры
и(или) на адапторную ф-цию тРНК-способность каждой тРНК узнавать свой кодон
(участок мРНК из трех нуклеотидных остатков, кодирующий определенную аминокислоту;
см. Генетический код
). На присоединение к тРНК аминокислот (акцепторную
ф-цию) миноры, как правило, не влияют.
Более половины пуриновых
и пиримидиновых оснований тРНК с помощью водородных связей образуют внутрицепо-чечные
пары по принципу комплементарности
(A-U, G-C, G-U; U и G-соотв. остатки
уридина и гуанозина), формируя 4 двухспиральных участка. Эти короткие спирали
чередуются с участками неспаренных оснований, в результате чего нуклеотидная
цепь образует 3 петли. Таким образом формируется вторичная структура, получившая
назв. клеверного листа (см. рис.). В ней выделяют: акцепторную ветвь (стебель,
черешок) с универсальной 3-концевой последовательностью, служащей акцептором
(местом прикрепления) остатка аминокислоты; дигидроуридиловую ветвь (шпильку),
варьирующую по числу входящих в ее состав нуклеотидов и содержащую до 3 остатков
дигидро-уридина (DHU); антикодоновую ветвь (шпильку) с петлей в 7 нуклеотидных
остатков, в центре к-рой находится анти-кодон (тринуклеотид, комплементарный
кодону мРНК и обусловливающий специфичность тРНК к этому кодону); тимидилпсевдоуридиловую
ветвь, или Ty-шпильку, содержащую минорные нуклеозиды риботимидин
и псевдоури-дин.
Кроме того, у всех тРНК
между Ty-шпилькой и акцепторным стеблем имеется вариабельная петля
(V-петля). Число составляющих ее нуклеотидов у разл. тРНК варьирует от 3 до
20. Если петля длинная, то формируется дополнит. пятый двухспиральный участок
тРНК, как, напр., у дрожжевых тРНКSer и тРНКLeu (в верхнем
индексе-условные обозначения аминокислот, к к-рым специфичны данные тРНК; букв.
обозначения см. в ст. Аминокислоты
).
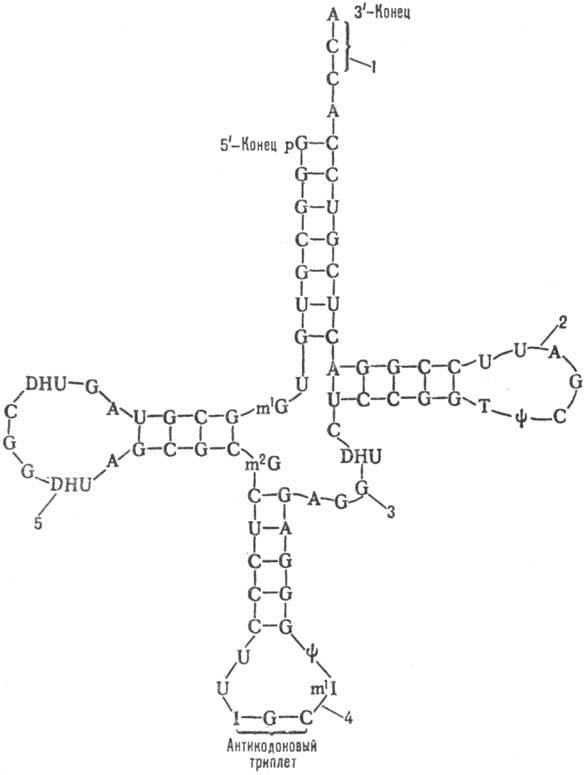
Нуклеотидная последовательность
и вторичная структура дрожжевой алани-новой тРНК; линии между антипараллельными
участками обозначают водородные связи между комплементарными парами оснований
(р-остаток фосфорной к-ты); молекула содержит семь минорных нуклеозидов: y-псевдо-уридин,
1-инозин, Т-риботимидин. DHU-5,6-дигидроуридин, m1I-1-метили-нозин,
m1G-1-метилгуанозин, m2G-N2-диметилгуанозин:
1-акцепторная ветвь, 2-Тy-шпилька, S-V-петля, 4-антикодонная ветвь, 5-дигидроуриди-ловая
ветвь.
Все тРНК имеют сходную
пространственную укладку цепи, напоминающую лат. букву L. Акцепторная и тими-дилпсевдоуридиловая
ветви расположены по одной оси, формируя непрерывную двойную спираль, состоящую
из 12 пар нуклеотидных остатков; антикодоновая и дигидроури-диловая ветви располагаются
также по одной оси, формируя вторую двойную спираль, включающую 9 пар нуклеотидных
остатков. Эти два спиральных участка располагаются под углом ок. 90° друг
к другу. Трехмерная структура поддерживается нековалентными связями между Ty-
и DHU-шпильками, а также др. взаимод., в т.ч. с ионами Mg2+. Конформация
тРНК в р-ре в целом соответствует ее конформации в кристалле. Важная особенность
структуры тРНК заключается в том, что антикодон, находящийся в центре полинуклеотидной
цепи и на одном из концов "L", доступен для контактов с мРНК.
В присут. АТФ, ионов Mg2+
и аминоацил-тРНК-синтетаз
к группе 3-ОН 3-концевого аденозина тРНК
присоединяется остаток аминокислоты с образованием аминоацил-тРНК. Аминоацил-тРНК
в рибосоме с помощью антико-дона комплементарно связывается с соответствующим
ко-доном мРНК. тРНК, акцептирующие разл. аминокислоты, имеют разные последовательности
оснований, благодаря чему синтетазы легко их узнают. Через взаимод. кодон-антикодон
осуществляется перевод нуклеотидной последовательности мРНК в специфич. аминокислотную
Последовательность синтезируемой полипептидной цепи.
Ошибка в узнавании аминокислоты
своей тРНК при синтезе аминоацил-тРНК не может быть исправлена на последующих
этапах белкового синтеза; последовательность аминокислотных остатков в синтезируемой
полипептидной цепи определяется мРНК и аминоацил-тРНК, взаимодействующими в
рибосоме, а не природой аминокислотного остатка, связанного с тРНК. Для большинства
тРНК с короткой V-петлей важную роль при взаимном узнавании фермента и тРНК
играет антикодон, для тРНК с длинной V-петлей-двухспиральные участки. При узнавании
происходят взаимные конформац. изменения тРНК и фермента.
Как правило, каждая аминокислота
имеет неск. соответствующих ей разновидностей тРНК, незначительно различающихся
по первичной структуре и наз. изоакцептор-ными; их подразделяют на мажорные
(доминирующие) и минорные (малочисленные). Структурные различия обусловлены
заменами неск. нуклеотидов (или пар нуклео-тидов) в разл. частях молекулы (в
т.ч. в антикодоне) и существенно не отражаются на укладке цепей. Для считывания
разных кодонов мРНК, соответствующих одной и той же аминокислоте, используются
изоакцепторные тРНК с разными антикодонами. Для мн. аминокислот число соответствующих
им изоакцепторных тРНК с разными антикодонами гораздо меньше, чем
общее число кодонов (напр., 24 митохондриальных тРНК достаточно для узнавания
61-62 смысловых кодонов мРНК). Из этого следует, что одна и та же тРНК может
узнавать неск. кодонов, кодирующих одну и ту же аминокислоту, но различающихся
по одному нуклеотиду.
Число генов, кодирующих
тРНК для одной и той же аминокислоты, может различаться у разных организмов
более чем на порядок. Общее число генов тРНК в разл. организмах сильно варьирует
(напр., у кишечной палочки Escherichia coli их ок. 70, у шпорцевой лягушки Xenopus
laevis ок. 7 тыс., у человека св. 1 тыс.). При транскрипции
(синтез РНК
на ДНК-матрице) генов тРНК с помощью фермента РНК-полимеразы III образуются
предшественники тРНК (пре-тРНК). Дальнейшее их превращение в тРНК включает ряд
ферментативных р-ций, приводящих к уменьшению размеров молекул и модификации
нек-рых нуклеозидов. В-генах тРНК эукариот функционально важный 3-концевой
триплет не кодирован-он достраивается посттранскрипционно с помощью фермента
тРНК-нуклео-тидилтрансферазы.
Помимо акцепторно-адапторной
ф-ции в белковом синтезе, мн. тРНК выполняют роль затравки при обратной транскрипции
(синтезе ДНК на РНК-матрице) благодаря комплементарности 3-конца тРНК (17-20
нуклеотидов) и участка РНК ретровирусов, а также др. ретротранспозонов. На 3-концах
РНК мн. вирусов растений присутствуют тРНК-подобные структуры, обладающие акцепторной
активностью. Нек-рые тРНК участвуют в биосинтезе пеп-тидогликанов (компонентов
внеш. оболочки нек-рых бактерий), в переносе аминокислот через внеш. мембрану
клеток, в регуляции биосинтеза ряда аминокислот, в посттрансляционной модификации
белков (перенос аминокислотного остатка от аминоацил-тРНК на N-конец полипептидной
цепи под действием ферментов аминоацил-тРНК-протеин трансфераз), а также во
внутриклеточной деградации белков. Имеются данные об участии тРНК как кофактора
в р-ции восстановления глутаминовой к-ты при биосинтезе хлорофилла. Успехи в
изучении структуры и функции тРНК сыграли исключит. роль в понимании общих принципов
структурной организации нуклеиновых к-т, в познании биосинтеза белков.
В 1955 Ф. Крик предсказал
существование в клетках малых молекул, ковалентно связывающихся с помощью особых
ферментов с аминокислотами и участвующих в адаптации (приспособлении) аминокислот
к генетич. коду, записанному в нуклеотидной форме (т. наз. адапторная гипотеза).
Такими молекулами оказались тРНК и "рН5-фер-менты", названные позднее
аминоацил-тРНК-синтетазами. тРНК открыли в 1957 М. Хоглэнд, М. Стефенсон и П.
Замеч-ник (США) и одновременно К. Огата и X. Нохара (Япония).
Впервые нуклеотидную последовательность
тРНК установили в 1965 Р. Холли с сотрудниками (США) для дрожжевой тРНКАlа.
За последующие 25 лет была расшифрована первичная структура сотен тРНК из разл.
организмов (бактерии, дрожжи, млекопитающие и др.). В 1974 А. Рич с сотрудниками
(США) и А. Клуг с сотрудниками (Великобритания) впервые с помощью рентгеноструктурного
анализа установили трехмерную структуру дрожжевой тРНКРhе в кристалле.
Позже трехмерные структуры нек-рых др. тРНК были расшифрованы в др. лабораториях.
тРНК-первые нуклеиновые
к-ты, для к-рых была установлена сначала первичная, а затем трехмерная структура
их молекул, что имело принципиальное значение для развития мол. биологии, химии
прир. соединений и биоорг. химии.
Лит.: Венкстерн
Т. В., в кн.: Итоги науки и техники, сер. Молекулярная биология, т. 18, М.,
1982, с. 49-109; Киселев Л. Л., Фаворова О. О., Лав-рик О. И., Биосинтез белков
от аминокислот до аминоацил-тРНК, М., 1984; Спирин А. С., Молекулярная биология.
Структура рибосом и биосинтез белка, М., 1986; Transfer RNA: Structure, properties
and recognition, eds. P. Schimmel a. o., N.Y., 1979; Transfer RNA: biological
aspects, eds. D. Soil a.o., N.Y., 1980; Schulman L., "Progr. Nucl. Acids,
Res. and Mol. Biol.", 1991, v. 41, p. 23,
|

