ТРИАЦЕТОНАМИН
(2,2,6,6-тетраметил-4-оксошшеридин),
мол. м. 171,24; бесцв. кристаллы, т. пл. 35-36 °С, т. кип. 102-105°С/18
ммрт.ст.;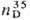 1,4600.
Раств. в воде и орг. р-рителях; кристаллизуется из ССl4 и углеводородов.
С водой образует моногидрат с т. пл. 58 °С. Т.-сильное основание, с минер.
и орг. к-тами образует устойчивые соли.
1,4600.
Раств. в воде и орг. р-рителях; кристаллизуется из ССl4 и углеводородов.
С водой образует моногидрат с т. пл. 58 °С. Т.-сильное основание, с минер.
и орг. к-тами образует устойчивые соли.
T.-g-пиперидон;
обладает св-вами ке-тонов (р-ции по карбонильной группе с гидроксиламином,
гидразином, HCN, NaBH4, фенолами, тиолами и др.) и вторичных аминов
(р-ции с образованием N-нитрозо-, N-галоген-, N-алкил- и N-ацилпроизводных).
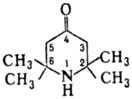
Для Т. характерны также р-ции по активир. метиленовым группам в положениях 3
и 5: аминометилируется по Манни-ха реакции, конденсируется с ароматич.
альдегидами. С формальдегидом в присут. оснований протекает альдольная конденсация
с образованием соед. I:
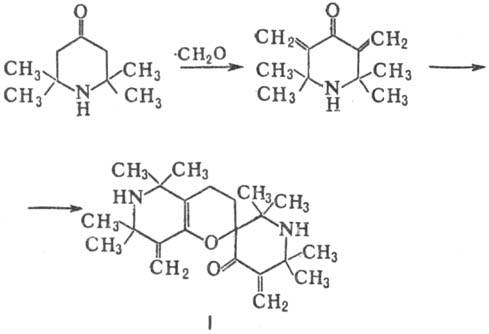
При действии Вr2
Т. образует 3,5-дибромпроизводное, к-рое при действии оснований претерпевает
перегруппировку Фаворского с образованием производных 2,2,5,5-тетра-метилпирролина,
напр.:
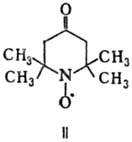
При окислении системой
Na2WO4-H2O2 или надбензой-ными к-тами
Т. превращ. в стабильный нитроксильный радикал 2,2,6,6-тетраметил-4-оксопиперидин-1-оксил
(II).
В пром-сти Т. получают
конденсацией ацетона с NH3 в присут. катиони-та КУ-2 при 50 °С
(промежуточно образуется 2,2,4,4,6-пентаметил-2,3,4,5-тетрагидропиримидин) с
послед. ректификацией реакц. массы. Др. способы получения - конденсация ацетона
с NH3 в присут. СаСl2, взаимод. форона (2,6-диметил-2,5-гептадиен-4-она)
с NH3, диацетонового спирта (4-гидро-кси-2-метил-2-пентанона) с NH3
и ацетоном.
Т.-исходное в-во для получения
устойчивых нитроксиль-ных радикалов ряда пиперидина, в пром-сти-светостабили-затор
полимеров. ПДК 30 мг/м3.
Лит.: Розанцев Э.
Г., Каган Е. Ш., Шолле В. Д., в кн.: Нитроксильные радикалы, М., 1987, с. 5-42;
Dagonneau М. [е. a], "Synthesis", 1984, № 11, р. 895 916. Е.Ш.
Каган.
|

