ТРИФЕНИЛХЛОРМЕТАН
(трифенилметилхлорид,
тритилхлорид) (C6H5)3CCl,
мол. м. 278,8; бесцв. кристаллы гексагон. сингонии (а =1,39 нм, с = 0,131
нм, z = 6); т.пл. 115 0C, т. кип. 310 0C, 230-235
°С/20 мм рт. ст.; С°р 123,3 Дж/(моль·К) (644,3 К); 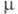 6,59-10-30
Кл·м; хорошо раств. в диэтиловом эфире, хлороформе, бензоле, хуже - в ацетоне.
6,59-10-30
Кл·м; хорошо раств. в диэтиловом эфире, хлороформе, бензоле, хуже - в ацетоне.
T. в р-ре жидкого SO2
диссоциирует на сольватир. карбкатион желтого
цвета и анион:
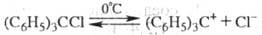
Ионизация T. происходит
также в пиридине, р-ре SbCl5, SnCl4, H2SO4.
При взаимод. с нек-рыми металлами (напр., Hg, Ag или Zn) в бензоле без доступа
O2 T. образует устойчивый трифенилметильный радикал (C6H5)3C0,
находящийся в равновесии с
димером: в присут. O2 превращ. в трифенилметилпероксид (C6H5)(COOC(C6H5)3.
Р-ция T. с амидом Na или амальгамой Na в
диэтиловом эфире приводит к образованию темно-красного р-ра
трифенилметилнатрия (тритилнатрия):

T. легко вступает в р-ции
нуклеоф. замещения, что обусловлено образованием
устойчивого трифенилметильнго карбкатиона. В
присут. Na2CO3 легко гидролизуется до трифенилкарбинола.
При взаимод. с первичными
спиртами ROH при 20-25 0C в присут. пиридина
с высоким выходом превращ. в простые тритиловые эфиры
(C6H5)3COR: с солями орг. к-т - в сложные (C6H5)COOR:
с NH3,
аминами и гидразином - в соответствующие N-тритильные производные.
Эти р-ции применяют в орг. химии для защиты первичных
спиртовых групп в сахарах или аминогрупп в аминокислотах.
Осн. методы получения T.
взаимод. бензола с CCl4 в присут. AlCl3
по р-ции Фриделя - Крафтса, нагревание трифенилметана с
PCl5, взаимод. трифенилкарбинола с конц. HCl, PCl3 или
CH3COCl в
бензоле, напр.:

Производные T. применяют
в качестве красителей (см. Арилметановые красители
).
Лит.: Физер Л.,
Физер M., Органическая химия, пер. с англ.. 2 изд., т. 1, M., 1970; Робертс
Д., Kaсерио M., Основы органической химии, пер.
с англ., т. 2, M., 1978; Chemistry of carbon compounds, ed.
by E. II. Rodd, v. 3, pt B, Amst.-[а.о.], 1956, p. 1087. С. И. Диденко.
|

