ТУЛИЙ
(от греч. Thule - Туле, у античных географов - край-ний северный предел
мира; лат. Thulium) Tm, хим. элемент III гр. периодич. системы; относится к
редкоземельным эле-ментам (иттриевая подгруппа лантаноидов), ат. н. 69,
ат. м. 168,9342. В природе один стабильный нуклид 169Tm. Конфи-гурация
внеш. электронных оболочек атома 4f135s25p66s2;
сте-пени окисления +3, +2, реже +4; энергии ионизации при по-следоват. переходе
от Tm0 к Tm5+ соотв. 6,181, 12,05, 23,68, 42,69, 65,4
эВ; электроотрицательность по Полингу 1,0-1,2; атомный радиус 0,174 нм, ионные
радиусы Tm3+ (в скобках указаны координац. числа) 0,102 нм (6), 0,113
нм (8), 0,119 нм (9), Tm2+ 0,117 нм (6), 0,123 нм (7).
Содержание в земной коре
2,7·10-5% по массе, в морской воде 1·10-7 мг/л. Вместе
с др. РЗЭ содержится в ксенотиме, эвксените, монаците, бастнезите, лопарите,
ортите и нек-рых др. минералах.
Свойства. Т.- серебристо-белый
металл, кристаллич. ре-шетка гексагон. типа Mg, а=0,35375 нм, с = 0,55546 нм, z=2, пространств, группа P63/mmc; т.пл. 1545 0C,
т.кип. 19470C; плотн. 9,318 г/см3; С°р
27,0 Дж/(моль·К);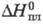 16,9 кДж/моль,
16,9 кДж/моль, 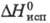 191 кДж/моль,
191 кДж/моль, 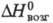 232 кДж/моль;
232 кДж/моль; 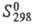 74,0 Дж/(моль·К); давление пара 9,66 кПа (1545 0C); температурный
коэф. линейного расширения 5,8· 10-6K-1 (300 К); r
9·10-7 Oм·м; антиферромагнетик ниже 58 К (точ-ка Нееля); твердость
по Бринеллю 471 МПа. Легко поддается мех. обработке.
74,0 Дж/(моль·К); давление пара 9,66 кПа (1545 0C); температурный
коэф. линейного расширения 5,8· 10-6K-1 (300 К); r
9·10-7 Oм·м; антиферромагнетик ниже 58 К (точ-ка Нееля); твердость
по Бринеллю 471 МПа. Легко поддается мех. обработке.
На воздухе компактный T.
практически не окисляется, при нагр. во влажном воздухе слабо окисляется. С
минер, к-тами реагирует,
давая Tm3+. Взаимод. с галогенами, халькогенами и N2 при
нагревании. В водных средах находится в виде производных Tm(III). Существуют
разл. комплексные соед. Tm(III) с орг. и неорг. лигандами. В присяг, сильных
восстановителей (щелочные металлы) Tm3+ м.б. переведен в Tm2+;
таким образом, напр., были получены TmX2, где X = Cl, Br, I. Соед.
Tm(II) легко гидролизуются водой, окисляются O2 воздуха и водой.
В халькогенидных системах T. существует в виде Tm(III) и Тт(II).
Сесквиоксид Tm2O3
- бесцв. с зеленоватым оттенком кристаллы; существуют в двух модификациях: кубической
(а = 0,104866 нм, пространств, группа laЗ, z= 16) и моноклинной (а
=1,381 нм, b = 0,3447 нм, с = 0,8505 нм, b = 100,20°,
z = 6, пространств, группа С2m), к-рая образуется при нагр. кубич.
формы ок. 1000 0C и давлении 4 МПа; т. пл. 237O0C; С°р
116,7 Дж/(моль·К); 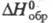 -1888,7 кДж/моль,
-1888,7 кДж/моль, 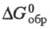 -1794,5 кДж/моль;
-1794,5 кДж/моль; 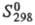 139,6 Дж/(моль·К); получают при нагр. нитратов, сульфатов, оксалатов и др. соединений
T. на воздухе выше 800-900 0C; входит в состав разл. оксидных материалов,
в т. ч. стекол, керамик (напр., со св-вами высокотемпературных сверхпроводников).
139,6 Дж/(моль·К); получают при нагр. нитратов, сульфатов, оксалатов и др. соединений
T. на воздухе выше 800-900 0C; входит в состав разл. оксидных материалов,
в т. ч. стекол, керамик (напр., со св-вами высокотемпературных сверхпроводников).
Трифторид TmF3-
бесцв. кристаллы, плавленый -бледно-зеленого цвета; существует в двух модификациях:
ромбической типа Fe3C (а = 0,6283нм , b = 0,6811 нм,
с = 0,4408 нм, z = 4, пространств, группа Рпта, плотн.
7,95 г/см3) и выше 1050 0C - гексагональной типа (а_ = 0,4059 нм, с = 0,4175 нм, z=1, пространств, группа
C3m1, плотн. 6,30 г/см3); т. пл. 1158 0C; DH0пл
28,9 кДж/моль,
(а_ = 0,4059 нм, с = 0,4175 нм, z=1, пространств, группа
C3m1, плотн. 6,30 г/см3); т. пл. 1158 0C; DH0пл
28,9 кДж/моль, 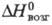 425 кДж/моль,
425 кДж/моль, 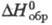 -1695 кДж/моль; получают из р-ров солей Тm(Ш) осаждением фтористоводородной
к-той, взаимод. Tm2O3 с F2 при нагр.; применяют
для металлотермич. получения металлического T.
-1695 кДж/моль; получают из р-ров солей Тm(Ш) осаждением фтористоводородной
к-той, взаимод. Tm2O3 с F2 при нагр.; применяют
для металлотермич. получения металлического T.
Трихлорид TmCl3
- бледно-желтые кристаллы с моноклинной решеткой типа AlCl3 (а
=0,675 нм, b=1,173 нм, с = 0,639 нм, b =110,6°, z = 4,
пространств, группа С2/m); T. пл. 828 0C, T. кип. 1487 0C;
давление пара 20,7 Па (828 0C); 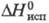 187 кДж/моль,
187 кДж/моль, 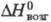 280 кДж/моль; образует гидраты; получают взаимод. смеси Cl2 и CCl4
с оксалатом T. при нагр. выше 200 0C либо хлорированием Т.; используют
для получения металлического T. и его соединений.
280 кДж/моль; образует гидраты; получают взаимод. смеси Cl2 и CCl4
с оксалатом T. при нагр. выше 200 0C либо хлорированием Т.; используют
для получения металлического T. и его соединений.
Получение. При переработке
концентратов РЗЭ T. концентрируется с наиб. тяжелыми элементами - Yb и Lu. Разделение
и очистку осуществляют экстракц. методом или ионообменной хроматографией с использованием
комплексонов.
Металлический T. получают
термич. восстановлением TmF3 кальцием или Tm2O3
лантаном.
T. выпускают в небольших
масштабах и в виде Tm2O3 используют как активатор люминофоров
для мед. радиографии (LaOBr - Tm, голубое свечение) и лазерных материалов (Er2O3
- Tm, CaWO4 - Tm), а также для изготовления синте-тич. фанатов. Искусств,
радиоактивный нуклид 170Tm (Т1/2 128,6 сут) - источник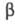 -излучения
в портативных рентгеновских мед. установках.
-излучения
в портативных рентгеновских мед. установках.
T. открыт в 1879 П. Клеве
в виде оксида - тулиевой "земли".
Л. И. Мартыненко, С. Д. Моисеев, Ю. M. Киселев.
|

