 |
Реклама |
|
|
 |
Для тяжелого льда
Кристаллы D2O
имеют такую же структуру, как и кристаллы обычного льда, различие в размерах
элементарной ячейки очень мало (0,1%). Изменение объема при плавлении тяжелого
льда 1,57 см3/моль (0,97 значения изменения объема для H2O).
Молярный объем твердой D2O при 273,15 К ~ 19,670 см3.
См. также табл. 1, 2. T а б л. 1. - СВОЙСТВА
ТЯЖЕЛОЙ ВОДЫ И ЕЕ НАСЫЩЕННОГО ПАРА
Табл. 2.- ПОЛОЖЕНИЕ
ОСНОВНЫХ ПОЛОС ПОГЛОЩЕНИЯ В ИK СПЕКТРЕ, см-1
T. в. менее летуча, чем
H2O. Отношение значений давления паров H2O и D2O
в интервале 277-387 К: ln Это отношение с ростом
т-ры уменьшается до 1 при 498 К, при
т-рах выше 498 К D2O становится более летучей, чем H2O.
Давление пара HDO Отношение значений давления
паров D2O и H2O над твердой фазой в интервале 243-273
К Ig Р-римость, а также растворяющая
способность D2O, как правило, ниже, чем у H2O, хотя известны
и обратные эффекты. Так, р-римость в D2O ниже, чем в H2O,
у сулемы при 0 0C на 42%, K2Cr2O7
при 5 0C на 33,5%, K2SO4 при 25 0C
на 20,5%. Р-римость
D2O в орг. жидкостях по сравнению с H2O снижается при
25 0C в триэтиламине на 30%, CS2 на 21,0%, бензоле на
17%, CHCl3 на 15%, хлорбензоле на 12%. Наблюдается также изменение
критич. т-ры растворения, напр.: в системе C3H7COOD -
D2O на 22,4 К, C6H5OD - D2O на 19,9
К. T. в. слабее ионизирована,
чем H2O. Константа ионизации D2O при 298,15 К lg K=-14,71.
Значения e (78,06 при 298,15 К), дипольного момента (6,24·10-30
Кл·м) и диамагнитной восприимчивости (при 293,15 К -1,295·10-5) D2O
почти не отличаются от тех же величин для H2O. Подвижность ионов
D3O+ в одной и той же среде на 28,5% ниже, чем у H3O+,
a OD- - на 39,8% ниже, чем у ОН-. Для мн. др. ионов различие
подвижностей в среде H2O и D2O составляет ок. 18%. Константа
диссоциации слабых к-т и оснований снижается в D2O по сравнению с
H2O, напр.: для уксусной к-ты 0,51·10-5 в D2O
и 1,7·10-5 в H2O, для бензойной к-ты соотв. 1,95·10-5
и 6,09·10-5. Большая прочность связи
D — О, чем H — О, обусловливает различия в кинетике р-ций T. в. и воды. Протолитич.
р-ции и биохим. процессы в D2O значительно замедлены. Однако существуют
и такие р-ции, скорость к-рых в T. в. выше, чем в H2O. В осн. это
р-ции, катализируемые ионами D+ и H+ или OD-
и OH-. Получение. T. в.
для ядерной техники должна иметь концентрацию не менее 99,81 молярных % D2O.
Совр. мировое произ-во составляет неск. тысяч т в год. Осн. страны-производители
- Канада, США, Индия, Норвегия. Получают T. в. выделением из воды или водорода
с естеств. изотопным составом. Ввиду малости коэф. разделения и низкого содержания
в сырье произ-во T. в. разделяют на 2 стадии - начальное концентрирование (от
прир. концентрации до 5-10% в пересчете на D2O) и конечное концентрирование
(от 5-10% до 99,8% D2O). Осн. пром. способы на первой стадии: изотопный
обмен между водой и H2S в двух-, трехступенчатой каскадной системе
противоточных колонн по двухтемпера-турной схеме (см. Изотопов разделение
);
многоступенчатый электролиз воды в сочетании с каталитич. изотопным обменом
между водой и H2; низкотемпературная ректификация жидкого H2
с послед, сжиганием D2 с O2; изотопный обмен между H2
и NH3 в присут. KNH2 и др. Для конечного концентрирования
T. в. в осн. используют ректификацию воды под вакуумом или электролиз. Для определения концентрации
D2O в воде используют денсиметрию (пикнометрич., поплавковый и капельный
методы), катарометрию (по изменению теплопроводности), рефрактометрию, ИК спектроскопию,
масс-спектрометрию и др. методы. Применение. T. в.-
лучший замедлитель нейтронов; коэф. замедления нейтронов 5700, поперечное сечение
захвата тепловых нейтронов 0,46·10-30 м2 (для воды соответствующие
величины 61 и 0,33·10-28 м2). Поэтому T. в. применяют
гл. обр. в качестве замедлителя нейтронов и теплоносителя в энергетич. и исследовательских
ядерных реакторах на тепловых нейтронах (тяжеловодные реакторы). Перспективно
использование T. в. как источника D2 для термоядерного синтеза. T.
в.- источник дейтронов в ускорителях частиц, изотопный индикатор, р-ритель в
спектроскопии ЯМР. T. в.- яд, т. к. замедляет
биол. процессы, действует угнетающе на живые организмы. T. в. открыта в 1932 Г.
Юри, Ф. Брикведде и Дж. Мёрфи , впервые получена в чистом виде и изучена в 1933
Г. Льюисом и P. Макдональдом. Лит.: Киrшенбаум
И., Тяжелая вода. Физические свойства и методы анализа, пер. с англ., M., 1953;
Шатенштейн А.И., Изотопный анализ воды, 2 изд., М., 1957; Казавчинский Я. 3.
[и др.], Тяжелая вода, тепло-физические свойства, M.-Л., 1963; Андреев Б.M.,
Зельвенский Я.Д., Катальников С. Г., Тяжелые изотопы водорода в ядерной технике,
M., 1987. Я. Д. Зельвенский. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 2HDO с константой равновесия К, близкой к 4,0 при 300-400 К. Поэтому
дейтерий при малом содержании присутствует в воде почти целиком в форме HDO,
а при высоком - в форме D2O. Для газа D2O
2HDO с константой равновесия К, близкой к 4,0 при 300-400 К. Поэтому
дейтерий при малом содержании присутствует в воде почти целиком в форме HDO,
а при высоком - в форме D2O. Для газа D2O 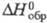 -249,200 кДж/моль, HDO -245,270
кДж/моль; отношение значений
-249,200 кДж/моль, HDO -245,270
кДж/моль; отношение значений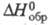 D2Oж и Н2ОЖ 1,027 (ж - жидкость);
для D2жx С°р 84,31 Дж/(моль·К),
D2Oж и Н2ОЖ 1,027 (ж - жидкость);
для D2жx С°р 84,31 Дж/(моль·К), 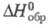 -294,60 кДж/моль,
-294,60 кДж/моль, 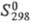 75,90 Дж/(моль·К); энергия разрыва связей (кДж/моль) при 298,15 К для D2O
75,90 Дж/(моль·К); энергия разрыва связей (кДж/моль) при 298,15 К для D2O ODо + Dо
508,276; HDO
ODо + Dо
508,276; HDO ОНо +Dо 506,184 и HDO
ОНо +Dо 506,184 и HDO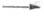 ODо
+ Hо 500,323 (для H2O 498,7 кДж/моль). Строение молекул
D2O такое же, как молекул H2O, с очень малым различием
в значениях длин связей и углов между ними. Для конденсир. состояния характерна
водородная связь.
ODо
+ Hо 500,323 (для H2O 498,7 кДж/моль). Строение молекул
D2O такое же, как молекул H2O, с очень малым различием
в значениях длин связей и углов между ними. Для конденсир. состояния характерна
водородная связь.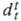 1,10735,
макс. плотн. 1,10602
г/см3 при 11,24 0C; скорость звука в T. в. 1386 м/с (20
0C);
1,10735,
макс. плотн. 1,10602
г/см3 при 11,24 0C; скорость звука в T. в. 1386 м/с (20
0C);  67,8 мН/м (20 0C), для смесей
67,8 мН/м (20 0C), для смесей 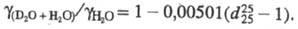 Отношение значений уд.
Отношение значений уд. 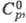 теплопроводности
теплопроводности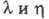 D2O и H2O:
D2O и H2O: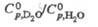
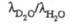
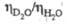
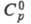 при
270 К 44,128 Дж/(моль·К). Отношение значений
при
270 К 44,128 Дж/(моль·К). Отношение значений 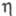 паров D2O и H2O в интервале 353-403 К в среднем равно
1,06. Коэф. самодиффузии при 318,15 K DD2о 2,979·10-9
м2/с. Коэф. диффузии изотопных форм
воды:
паров D2O и H2O в интервале 353-403 К в среднем равно
1,06. Коэф. самодиффузии при 318,15 K DD2о 2,979·10-9
м2/с. Коэф. диффузии изотопных форм
воды: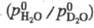 =
-70,87/T+ 33630/Т2.
=
-70,87/T+ 33630/Т2.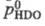 =
=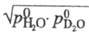 . При постоянной т-ре козф. разделения
жидкость - пар для смеси H2O + D2O
. При постоянной т-ре козф. разделения
жидкость - пар для смеси H2O + D2O 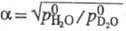 и
не зависит от соотношения
D/H;
и
не зависит от соотношения
D/H; 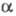 =
1,026 (373 К), 1,053 (323 К). Смеси H2O + D2O практически
ведут себя как идеальные р-ры.
=
1,026 (373 К), 1,053 (323 К). Смеси H2O + D2O практически
ведут себя как идеальные р-ры.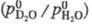 = 0,0376 — 35,65/Г.
Давление пара T. в. над кристаллогидратами солей на 10-20% ниже по сравнению
с H2O. Показатель преломления T. в.
= 0,0376 — 35,65/Г.
Давление пара T. в. над кристаллогидратами солей на 10-20% ниже по сравнению
с H2O. Показатель преломления T. в. 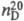 1,328300, молярная рефракция R 3,679, поляризуемость 1,45962·0-24
см3 при 293,15 К и длине волны 589,3
HM.
1,328300, молярная рефракция R 3,679, поляризуемость 1,45962·0-24
см3 при 293,15 К и длине волны 589,3
HM.